Анализ азота и его соединений
7.6.2. Фотометрический метод с сульфаниловой кислотой и ![]() -нафтиламином
-нафтиламином
Сущность метода. Метод аналогичен предыдущему методу, Сульфаниловая кислота реагирует с азотистой кислотой с образованием соответствующего диазосоединения, которое сочетается с а-нафтиламином, образуя азокраситель, имеющий пурпурную окраску:
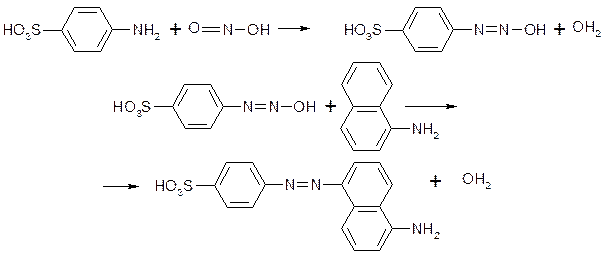
Интенсивность окраски возрастает по закону Бера в границах от 10 до 600 мкг/л в расчете на ![]() (от 3 до 180 мкг/л в расчете на азот) при толщине слоя жидкости в кювете 1 см,
(от 3 до 180 мкг/л в расчете на азот) при толщине слоя жидкости в кювете 1 см, ![]() =530 им. Молярный коэффициент поглощения
=530 им. Молярный коэффициент поглощения ![]() = 3,3•104.
= 3,3•104.
Некоторым недостатком метода по сравнению с методом 7.6.1 является применение токсичного реактива ![]() -нафтиламина. Следует остерегаться всасывания жидкости ртом при наборе ее в пипетку. Надо избегать также соприкосновения реактива с кожей рук.
-нафтиламина. Следует остерегаться всасывания жидкости ртом при наборе ее в пипетку. Надо избегать также соприкосновения реактива с кожей рук.
Мешающие вещества. Определению мешают те же вещества, какие мешают при использовании метода 7.6.1.
Реактивы.
Сульфаниловая кислота, раствор. Растворяют 600 мг сульфаниловои кислоты в 70 мл горячей дистиллированной воды, охлаждают, прибавляют 20 мл концентрированной соляной кислоты, разбавляют до 100 мл дистиллированной водой и тщательно перемешивают.
Гидрохлорид ![]() -нафтиламина, раствор. Смешивают 600 мг гидрохлорида
-нафтиламина, раствор. Смешивают 600 мг гидрохлорида ![]() -нафтиламина с 1 мл концентрированной соляной кислоты (или 480 мг основания
-нафтиламина с 1 мл концентрированной соляной кислоты (или 480 мг основания ![]() -нафтиламина смешивают с 1,4 мл соляной кислоты) и разбавляют дистиллированной водой до 100 мл.
-нафтиламина смешивают с 1,4 мл соляной кислоты) и разбавляют дистиллированной водой до 100 мл.
Ацетат натрия, 2 М раствор. Растворяют 27,2 г CH3COONa•H2O в дистиллированной воде, раствор фильтруют, если надо, и разбавляют водой до 100 мл.
Стандартные растворы нитрита натрия - см. метод 7.6.1.
Ход определения. Анализируемую воду нейтрализуют до рН = 7 и, если появится осадок или муть, фильтруют через мембранный фильтр № 1 (разбавление учитывают при расчете результата определения) .
В коническую колбу вместимостью 100 мл помещают 50 мл анализируемой воды (или фильтрата после отделения осадка, или меньший объем, но разбавленный до 50 мл дистиллированной водой). В отобранном объеме должно быть от 0,6 до 30 мкг ![]() . Прибавляют 1,0 мл раствора сильфаниловой кислоты и тщательно перемешивают. Значение рН полученной смеси должно быть около 1,4. Дают постоять от 3 до 10 мин, затем приливают 1,0 мл растворра
. Прибавляют 1,0 мл раствора сильфаниловой кислоты и тщательно перемешивают. Значение рН полученной смеси должно быть около 1,4. Дают постоять от 3 до 10 мин, затем приливают 1,0 мл растворра ![]() -нафтиламина, 1,0 мл раствора ацетата натрия и перемешивают. Полученный окрашенный раствор должен иметь рН от 2,0 до 2,5. Через 10-30 мин определяют его оптическую плотность при
-нафтиламина, 1,0 мл раствора ацетата натрия и перемешивают. Полученный окрашенный раствор должен иметь рН от 2,0 до 2,5. Через 10-30 мин определяют его оптическую плотность при ![]() = 530 им в кюветах с толщиной слоя жидкости 1 или 5 см в зависимости от концентрации. Одновременно проводят холостой опыт с 50 мл дистиллированной воды и полученный в холостом опыте раствор используют в качестве сравнительного раствора при измерении оптической плотности.
= 530 им в кюветах с толщиной слоя жидкости 1 или 5 см в зависимости от концентрации. Одновременно проводят холостой опыт с 50 мл дистиллированной воды и полученный в холостом опыте раствор используют в качестве сравнительного раствора при измерении оптической плотности.
Результат определения находят по калибровочному графику, для построения которого вводят мерные колбы вместимостью 50 мл 0; 1; 2, ., 30 мл стандартного рабочего раствора II, разбавляют каждый раствор до метки дистиллированной водой и перемешивают. Далее продолжают, как при анализе пробы. По результатам измерения оптических плотностей строят калибровочный график или, что лучше, два графика: один, для определения самых малых концентраций, с расстоянием между стенками кюветы 5 см, другой - с расстоянием 1 см.
Ионы аммония и аммиака.
Ионы аммония и аммиак появляются в грунтовых водах в результате жизнедеятельности микроорганизмов. Так же объясняется присутствие их в питьевых водах, если эти вещества не прибавляли в смеси с хлором при водоподготовке. В поверхностных водах аммиак появляется в небольших количествах, обыкновенно в период вегетации, в результате разложения белковых веществ. В анаэробной среде аммиак образуется при восстановлении органических веществ. Вследствие жизнедеятельности нитрифицирующих бактерий содержание аммиака в водоемах снижается при одновременном образовании нитратов. Повышенное содержание аммиака в поверхностных водах объясняется спуском в них бытовых сточных вод и некоторых промышленных вод, содержащих значительные количества аммиака или солей аммония, являющихся отходами производства.
Отношение концентраций свободного аммиака (NH3) и ионов аммония (NH+4) зависит от концентрации водородных ионов. Концентрации отдельных форм можно определить расчетом.
Для определения аммиака приводится метод непосредственного колориметрического определения в питьевых и поверхностных водах с реактивом Несслера и метод отгонки с колориметрическим или объемным окончанием в зависимости от концентрации аммиака в пробе (определение в поверхностных и особенно в сточных водах). Если пробы для определения аммиака взяты не сразу же после отбора, их консервируют прибавлением 1 мл концентрированной серной кислоты или 2-4 мл хлороформа на 1 л пробы.
Полученные результаты выражают в мг-экв или в мг-ион NH+4/л воды: 1 мг NH+4 = 0,05544 мг-эке NH+4; 1 мг-экв NH+4= 18,04 мг NH+4.
Качественное определение.
К 10 мл пробы прибавляют несколько кристалликов сегнетовой соли и 0,5 мл реактива Несслера. Желтое окрашивание раствора, помутнение или выпадение желто-коричневого осадка указывает на присутствие аммиака. В присутствии повышенного количества органических веществ, особенно гуминовых кислот, вызывающих усиление коричневой окраски после подщелачивания, необходимо провести холостой опыт, добавив сегнетову соль и 0,5 мл 15%-нога раствора едкого натра.
Колориметрическое определение с реактивом Несслера.
Аммиак реагирует в щелочной среде с иодомеркуриатом калия, образуя осадок желто-коричневого цвета. При низкой концентрации аммиака получается коллоидный раствор, пригодный для колориметрического определения.
Низший предел определения равен 0,05 мг NH+4 в 1 л. Без разбавления можно определять не более 4 мг NH+4 в 1 л воды.
Мешающие влияния. Определению мешают амины, хлорамины, ацетон, альдегиды, спирты и некоторые другие органические соединения, реагирующие с реактивом Несслера. В их присутствии проводят определение аммиака с отгонкой.
Определению мешают компоненты, обусловливающие жесткость воды, железо, сульфиды, хлор, а также мутность.
Мешающее влияние жесткости воды устраняют прибавлением раствора сегнетовой соли или комплексона III.
