Изучение возможности применения магнитных жидкостей для синтеза магнитных сорбентов
2.3.6. Рентгенографическое исследование.
Рентгенограммы образцов записывали на рентгеновском дифрактометре HZG-4A (CoKα – излучение). Расшифровка рентгенограмм велась по стандартной методике и идентифицировалась по набору межплоскостных расстояний.
2.3.7. Дериватографичеекое исследование.
Исследование проводилось на приборе "ОД-102" в воздушной атмосфере в интервале температур 25-1000°С при скорости нагрева 5 град/мин. Скорость протяжки 1 мм/мин, ДТА 1/5, ДТГ 1/15 . Дериватографическому исследованию подвергались активированный уголь, активированный уголь смешанный с магнетитом и активированный уголь пропитанный магнитной жидкостью (водн., олеат ТЭА).
3. Результаты и их обсуждение.
В настоящей работе представлены новые методы получения магнитных сорбентов, основанные на использовании различных магнитных жидкостей. Использование именно жидкого материала для пропитки сорбента (и придания ему тем самым магнитных свойств) выгодно отличает предложенный нами способ от описанных в литературе. Применение различных магнитных жидкостей (в отличие от магнетита определенного состава) позволяет в широких пределах варьировать свойства получаемого сорбента.
Также был проведен анализ полученных нами магнитных жидкостей и магнитных сорбентов на их основе.
3.1. Рентгенофазовое исследование.
Известно [31], что свежеосажденная смесь оксидов соответствует составу Fe3O4. Через некоторое время двухвалентное железо окисляется и Fe3O4 переходит в γ-Fe2O3. Магнетит и γ-оксид железа очень похожи по структурным характеристикам. Разница в плотности упаковки. Так, упаковка γ-оксида более плотная чем у магнетита. Разницу между ними можно обнаружить на рентгенограмме лишь в области 74-75˚ угла 2θ. У Fe3O4 межплоскостное расстояние соответствует значению 74,105˚, а у γ-Fe2O3 – 74,723˚.
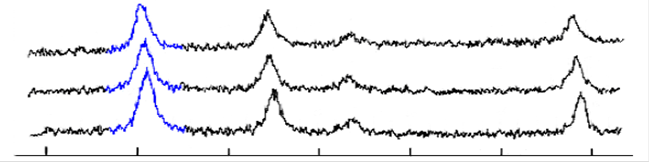
Анализируя полученные нами рентгенограммы (рис.9.) можно сделать вывод, что в слабощелочной среде окисление идет быстрее, чем при рН=10. А также с течением времени магнетит стехиометрического состава переходит в nFeO·mFe2O3 где m>n, и затем уже в γ-Fe2O3.
|
|
а б в | ||||||
|
80 |
75 |
70 |
65 |
60 |
55 |
50 |
2θ |
Рис. 9. Рентгенограммы образцов магнетита,
а) спустя 2 недели после синтеза, б) свежеосажденный, отмытый до рН=8,5, в) свежеосажденный, отмытый до рН=10.
|
|
а б | ||||||
|
80 |
75 |
70 |
65 |
60 |
55 |
50 |
2θ |
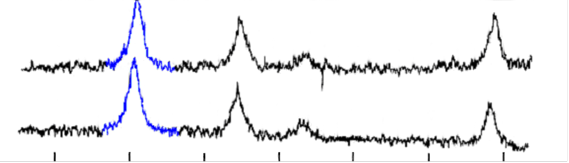
Рис. 10. Рентгенограммы образцов магнитных жидкостей в водной дисперсионной средой и смесью оксидов железа в качестве магнитного материала,
а) стабилизатор – олеат натрия, б) стабилизатор – олеат ТЭА.
Из анализа рентгенограмм (рис 10.) и данных количественного анализа следует, что в жидкостях, стабилизированных олеатом натрия, окисление двухвалентного железа идет медленнее по сравнению с жидкостями, стабилизированными олеатом ТЭА.
Что же касается концентрата магнитной жидкости на декане, то в нем, в отличие от водных МЖ и разбавленных МЖ на декане, окисление хоть и происходит, но в значительно меньшей степени.
|
|
а б в | ||||||
|
80 |
75 |
70 |
65 |
60 |
55 |
50 |
2θ |
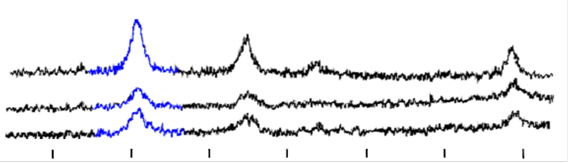
Рис. 11. Рентгенограммы а) магнетит, б) угольный магнитный сорбент, в) ионообменный магнитный сорбент
Рентгеноструктурный анализ образцов на основе магнетита (полученного путем соосаждения солей 2х- и 3х- валентного железа в аммиаке и отмытого методом магнитной декантации до рН=8,5) (рис.11) показал, что Fe2+ окисляется и со временем Fe3O4 переходит в g-Fe2O3. Это происходит примерно одинаково интенсивно в свежеосажденной смеси оксидов и магнитном сорбенте с активированным углем. В этих образцах состав магнитного материала представляет собой смесь Fe3O4 и g-Fe2O3.
При рентгеноструктурном анализе образцов магнитных сорбентов на основе магнитных жидкостей с органической и водной дисперсионной средой выяснилось, что в магнитном сорбенте на водной основе окисление происходит быстрее, чем в магнитных сорбентах, синтезированных из неводных магнитных жидкостей. А в целом, ситуация похожа на описанную выше.
3.6. Количественный анализ.
Количественный анализ проводился методами перманганато- и иодометрии. Данные представлены в табл.2 и на рис.12:
Таблица 2.
Изменение соотношения трех- и двухвалентного железа во времени.
|
№ |
№ метод. |
образец |
Fe(III)/Fe(общ), % | ||||||||
|
2 часа |
1 день |
3 дня |
1 нед. |
2 нед |
1 мес. |
3 мес. |
6 мес. |
1 год | |||
|
1 |
2.1.1. |
Магнетит |
67 |
72 |
78 |
85 |
92 |
96 |
98 |
100 |
100 |
|
2 |
2.1.3. |
МЖ (водн., олеат ТЭА) |
70 |
73 |
76 |
78 |
83 |
85 |
88 |
91 |
92 |
|
3 |
2.1.6. |
МЖ (декан, олеин. к-та) |
68 |
70 |
73 |
77 |
82 |
84 |
87 |
89 |
90 |
|
4 |
2.2.1. |
МС (уголь + магнетит) |
67 |
71 |
75 |
81 |
87 |
91 |
95 |
97 |
98 |
|
5 |
2.2.1. |
МС (ионнообм. + магнетит) |
67 |
70 |
73 |
79 |
84 |
88 |
91 |
93 |
94 |
|
6 |
2.2.3. |
МС (уголь + МЖ(водн., олеат ТЭА)) |
69 |
72 |
73 |
75 |
78 |
81 |
84 |
86 |
87 |
|
7 |
2.2.3. |
МС (уголь+ МЖ (декан, олеин. к-та)) |
68 |
71 |
72 |
74 |
76 |
79 |
82 |
84 |
85 |