Качественный анализ (кислотно-основная классификация)
3.Реакция с солями железа (III).
Тиоцианат- ионы образуют с катионами железа (III)в кислой (для подавления гидролиза железа (III)) среде тиоцианатные комплексы железа (III) красного цвета состава [FefNCS)n(H2O)6.n]3--, где п=1,2.,.,6.
4.Реакция с иодат - ионами. -
В кислой среде тиоцианат - ионы окисляются иодат - ионами с выделением свободного йода:
5SCN- + 6 Юз' + Н+ + 2 Н2О -> 5 SO42' + 5 HCN + ЗЬ
Методика. Фильтровальную бумагу смачивают свежеприготовленным раствором крахмала и высушивают. Получают крахмдльную бумагу. На нее наносят кашпо разбавленного раствора НС1, каплю раствора KNCS и каплю раствора иодата калия , КЮз. Бумага окрашивается в синий цвет вследствие образования синего молекулярного комплекса крахмала с йодом, выделяющимся в процессе реакции.
5.Другие реакции тиоцианат - ионов.
С нитратом ртути (II) Hg(NO3)2 они образуют белый осадок тиоцианата ртути (II) Hg(SCN)2, растворимый при избытке SCN- - ионов; с катионами Си-' - растворимые комплексы изумрудно - зеленого цвета или (при избытке катионов Си2+)черный осадок тиоцианата меди (II) Cu(SCN)2, который при нагревании превращается в белый тиоцианат меди (I) СиЗСЫ.Тиоцианат — ионы разлагаются растворами H2SO4,1INO3 и сильных окислителей, вступают в многочисленные реакции комплексообразоваиия, осаждения и т.д.
Аналитические реакции сульфид - иона S2-
Сульфид - ион S2- - бесцветный анион очень слабой двухосновной сероводородной кислоты H2S. В водных растворах сульфид — ион подвергается глубокому гидролизу, не склонен к образованию комплексов металлов. Средние сульфиды аммония, щелочных и щелочно - земельных металлов хорошо растворяется в воде, а остальные сульфиды мало растворимы в воде. Кислые гидросульфиды, содержащие гидросульфид - анион HS- хорошо растворяются в воде.
Сероводородная вода (раствор H2S в воде) окисляется кислородом воздуха с выделением элементной серы:
2 H2S + О2 -> S + 2 Н2О (вода мутнеет)
Сероводород H2S - весьма ядовит. Работать с сероводородной водой необходимо только под тягой!
1.Реакция с нитратом серебра.
S2- + 2 Ag+= Ag2S (черный)
Осадок Ag2S не растворяется в водном аммиаке, растворим в разбавленной азотной кислоте при нагревании с выделением элементной серы:
Ag2S + 4 HNO3 -> S + 2 NO2 + 2 AgNO3 + 2 Н2О
2.Реакция с сильными кислотами.
S2- + 2H+=H2St
При избытке ионов водорода равновесие смещается вправо и образующийся сероводород удаляется из сферы реакции. Ощущается характерный запах сероводорода. К отверстию пробирки подносят фильтровальную бумагу, пропитанную раствором ацетата свинца. Бумага чернеет вследствие выделения черного сульфида свинца: H,S + (СН3СОО)2РЬ -> PbS + 2 СН3СООН
3.Реакция с катионами кадмия.
S2- + Cd2+ = CdS (желтый)
Реакцию проводят в кислых и нейтральных растворах.
4.Реакция с нитропруссидом натрия.
S2- + [Fe(CN)5NO]2- -->■ [Fe(CN)5NOS]4-
Фиолетовый комплекс
5.Другие реакции сульфид - иона.
Образует малорастворимые сульфиды с катионами ряда металлов, обесцвечивает кислый раствор КМпО4 и раствор йода с выделением серы - и т.д.
Аналитические реакции анионов третьей аналитической группы: NO2-, NO3-, СН3СОО-; и некоторых органических анионов: тартрат-, цитрат-, бензоат- и салицилат- ионов
Группового реагента не имеется.
Аналитические реакции нитрит - иона NO2-.
Нитрит - ион - анион очень слабой одноосновной азотистой кислоты HNO2, которая в водных растворах при обычных температурах неустойчива и легко разлагается по схеме:
2 HNO2 = N2O3 + Н20
N2O3 = NO + NO2
В водных растворах гидролизуется; редокс — амфотерен. Нитриты хорошо растворяются в воде (нитрит серебра AgNO2 - при нагревании). Нитрит - ион образует комплексы со многими металлами. Некоторые из этих координационных соединений, в отличие от -простых- нитритов, мало растворимы в воде, например, гексанитрокобальтаты (III) калия K3[Co(NO2)6] и аммония (NH4)3[Co(NO2)6], что используют в качественном анализе. Нитриты токсичны!
1. Реакция с дифениламином (фармакопейная).
Реакцию проводят в концентрированной серной кислоте. Вначале происходит необратимое окисление дифениламина в дифенилбензидин:
2C6H5NHC6H5 — С6Н5 - NH - С6Н4 -С6Н4 - NH - С6Н5 + 2 Н+ + 2ё
дифениламин дифенилбензидин (бесцветный)
Две молекулы дифениламина отдают окислителю два электрона и теряют два иона водорода. Затем происходит обратимое окисление молекулы бензидина присутствующим окислителем до окрашенного в синий цвет дифенилдифенохинондиимина, при котором молекулы дифенилбензидина также отдает окислителю два электрона и теряет два иона водорода:
![]()
При стоянии синей смеси, ее окраска постепенно изменяется вначале на бурую, а затем - на желтую, вследствие необратимого разрушения синего продукта реакции.
Проведению реакции мешают как анионы - окислители (C103-,Br3, Cr207 и др.), так и анионы - восстановители (S2-, SO32-, S2O32-, 1- идр.).
Нитрат - ион NO3- дает аналогичную реакцию с дифениламином.
2. Реакция с сильными кислотами (фармакопейная).
NО2-+H+=HNO2
2HNO2 =N2O3 + Н20 — NO + NO2 + H2O (желто-бурые пары)
3.Реакция с иодидом калия (нитрит - ион - окислитель).
Нитрит - ион в кислой среде (НС1, H2SO4, CH3COOH) окисляет иодид - ионы до свободного иода:
2 N02- + 2 1- + 4 Н+ -> 12 + 2 N0 + 2 Н20
Образующийся йод обнаруживают реакцией с крахмалом (по посинению раствора) или экстрагируя его органическим растворителем - бензолом, хлороформом (органический слой окрашивается в фиолетовый цвет).
Нитрат - ион N03 не мешает проведению реакции, поэтому ионы N02- можно открыть в присутствии нитрат - ионов. Проведению реакции мешают окислители (МпО4-.Сг2О72- и др.).
4.Реакция с перманганатом калия (нитрит - ион - восстановитель).
5 N02- + 2 МпО4- + 6 Н+ — 5 N03- + 2 Мп2+ + 3 Н20
Проведению реакции мешают другие восстановители (S2-, SO32\ S2O32-, C2O42-, SCN\ АбОз3-,!-, Вг-), также реагирующие с МпО4- - ионами.
Нитрат - ион N03- не обесцвечивает раствор КМпО4 (отличие от нитрит - иона -фармакопейный тест). Розовый раствор перманганата калия обесцвечивается.
5.Реакция с реактивом Грисса - Илотвая.
Реактив Грисса - Илотвая - смесь сульфаниловой кислоты HSO3C6H4NIЬ с 1-нафтиламином C10P7NH2. Реакцию проводят в нейтральных или уксуснокислых растворах.Образующаяся в кислой среде в присутствии нитрит- иона азотистая кислота HN02 реагирует с сульфаниловой кислотой, давая соль диазония:
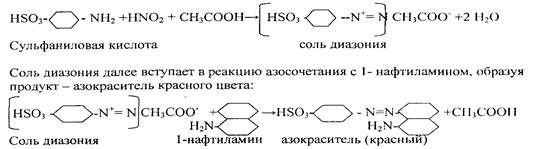
В результате раствор окрашивается в красный цвет.
Нитрат - ион NO3- аналогичной реакции не дает.
Вместо сульфаниловой кислоты используют и другие ароматические амины, а вместо 1-нафтиламина - 1 амино - 2- нафтол, 2- нафтол и т.д.
6. Реакция с солями аммония - реакция разложения (удаления) нитрит ионов.
N02 + NH4 = N2 + 2Н2О
Аналогична реакция с карбамидом:>
