Качественный анализ (кислотно-основная классификация)
3.Реакция с гексацианоферратом (II) калия.
2Cu2+ + [Fe(CN)6]4- — Си2[Ре(СЫ)6]|(красно-коричневый).
Капельный метод на фильтровальной бумаге: на лист фильтровальной бумаги, пропитанной раствором ферроцианида калия, наносят каплю раствора соли меди (II). На бумаге образуется красно-коричневое пятно.
Осадок не растворяется в разбавленных кислотах, но растворяется в 25%-м водном аммиаке:
Cu,[Fe(CN)6] + 12 NH3+ 4 Н2О — ( NH4)4[Fe(CN)6] + 2 [Cu(NH3)4](OH)2 Проведению реакции мешают катионы, также образующие окрашенные осадки .и ферроцианидов (Fe3+, Со2т, Ni2+).
4.Реакция с тиосульфатом натрия.
2Си2+ + 2 82О32Хиз6ыток) + 2 Н2О — Cu2S |(темно-бурый) + §j +4 H++~2SO42~
Выпадает темный осадок, содержащий смесь Cu:S и S.
5. Реакция с купроном (1-бензоиноксимом).
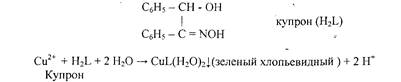
Реакцию проводят в аммиачной среде. Осадок не растворяется в избытке аммиака.
6. Реакция восстановления меди (II) металлами до металлической меди (фармакопейная).Реакцию дают металлы, расположенные в ряду напряжений металлов левее меди.
Cu2+ + Zn -- Си + Zn2+
Си2+ + Fe -> Си + Fe2+
3 Си2+ +2 А1 -► 3 Си +2 А13+
8. Соли меди окрашивают пламя газовой горелки в изумрудно-зеленый цвет. Реакция с тиоцианат - ионами.
Си2+ + 2 SCN- — Cu(SCN)2J-+ CuSCN| + SCN- Образуется черный осадок Cu(SCN)2, постепенно переходящий в белый CuSCN.
Другие реакции меди (II).
Катионы Си + с сульфид -ионами дают черный осадок сульфида меди CuS; с фосфатами- голубой осадок Си3(РО4)2. Известны реакции комплексообразования меди (II) с различными органическими реагентами - купроином, купфероном, дитиоксамидом и др.
Аналитические реакции катиона кадмия Cd2+
Акво-ионы кадмия [Cd(H2O),,]-+ в водных растворах бесцветны.
1.Реакция с щелочами и аммиаком.
Cd2+ + 2 ОН- -> Cd(OH)2 (белый)
Осадок Cd(OH)2 нерастворим в избытке щелочи, но растворяется в избытке аммиака с образованием бесцветного аммиачного комплекса [Cd(NH3)4]2+: Cd(OH)2 + 4 NH3 --[Cd(NH3)4]2+ + 2 ОН- Осадок Cd(OH)2 растворяется в кислотах:
Cd(OH)2 + 2 Н3О+ — [Cd(H2O)4]2+
2.Реакция с сульфид - ионами.
Cd2+ + S2- -> CdS (желтый)
Осадок CdS не растворим в щелочах и в растворе сульфида натрия, частично растворяется в насыщенном растворе хлорида натрия с образованием хлоридного комплекса кадмия [CdCl4]2+:
CdS + 4 Cl- -> [CdCl4]2- + S2+
CdS нерастворим в кислотах, за исключением НС1, в которой он растворяется с образованием хлоридного комплекса кадмия:
CdS + НС1 -> H2[CdCl4] +H2S
3.Реакция с тетраиодовисмутатом (III) калия.
Cd2++ 2 [Bil4]- -> Cd2+, + 3BiI3 |(черный)
4.Реакция с тетрароданомеркуратом (II) аммония.
Cd2++ [Hg(SCN)4]2- -> Cd[Hg(SCN)4]
Образованиебесцветных продолговатых кристаллов тетрароданомеркурата кадмия Cd[Hg(SCN)4]
Другие реакции Cd2+
Cd2+ реагирует с комплексоорганическими реагентами: дитизоном, кадионом, β-нафтохинолином, меркаптобензимидазолом, меркаптобензтиазолом и т.д.
Аналитические реакции катиона кобальта (II) Со2+
Акво - ионы кобальта (II) октаэдрической структуры [Со(Н2О)6]~ окрашены в розовый цвет, поэтому разбавленные водные растворы солей кобальта (II) также имеют розовую окраску. Однако при выпаривании водных растворов Со2 их окраска меняется на синюю, характерную для комплексов кобальта (II) тетраэдрической структуры. Соединения Со(П) легко окисляется до соединений Со (III), причем в ряде случаев - уже кислородом воздуха (растворенным в воде), что необходимо ;учитывать при проведении качественных реакций на кобальт (II). В водных растворах кобальт (II) и кобальт (III) присутствуют исключительно в форме комплексных соединений. Комплексы Со(Ш) устойчивее комплексов Со (II).
1.Реакция с щелочами.
СоС12 + ОН' -- СоОНСЦ(синий) + СГ
CoOHCl + ОН- -> Со(ОН)2|(розовый) + СГ
2 Со(ОН)2 + 0,5 О2 + Н2О — 2 Со(ОН)4(черно-бурый)
Если к розовому осадку Со(ОН)2 прибавить Н2О2, то реакция окисления Со(ОН)2 в черно-бурый Со(ОН)з протекает практически мгновенно:
2 Со(ОН)2 + Н2О2 -> 2 Со(ОН)3.
Действие смеси Н2О2 со щелочью на раствор соли кобальта (II) сразу приводит к образованию черно-бурого осадка Со(ОН)3:
2 СоС12 + 4 ОН- + Н2О2 -- 2 Со(ОН)3 + 4 СГ
2.Реакция с аммиаком.
СоС12 + NH3H2O -> СоОНСЦ(синий) + NH4C1 CoOHCl + 5 NH3 + NH4C1 -> [Co(NH3)6]CI2 (желтый) + H2O
При стоянии на воздухе, раствор постепенно меняет окраску на вишнево - красную, за счет окисления кобальта (II) до кобальта (III) с образованием хлоропентамминкобальт (III) - анионов [Co(NH3)5Cl]2- вишнево - красного цвета:
2 [Co(NH3)6]CI2 + О2 + 2 Н2О — 2 [Co(NH3)5Cl](OH)2 + 2 NH3 В присутствии Н2О2 и солей аммония реакция окисления [Co(NH3)6]2+ до [Co(NH3)5Cl]-+ протекает практически мгновенно:
2 [Co(NH3)6]Cl2 + 2 Н2О2+ 2 NH4CI -> 2 [Co(NH3)5Cl]Cl2 +4 NH3 + 2 Н2О
3.Реакция с тетратиоцианатомеркуратом (II) аммония (тетрароданомеркуратом (II) аммония).
Со2++ [Hg(SCN)4]2' — Co[Hg(SCN)4]i(TeMHO-CHHHe кристаллы) Из разбавленных растворов кристаллы выделяются медленно. Выпадает голубой осадок смешанного тиоцианатного комплекса цинка и кобальта (II):
XZn2+ + Yco2+ + (X+Y) [Hg(SCN)4]2- -+ ZnxCoy[Hg(SCN)4]x+5, Прибавление даже небольших количеств соли цинка приводит к почти полному осаждению кобальта (II). Проведению реакции мешают катионы Cd2, Cu2+, Fe3+, Ni2+.
4.Реакция с тиоцианат - ионами.
Со2++ 4 NCS- <-> [Co(NCS)4]2 (синий) Реакцию проводят в слабо кислой среде.
Комплекс в водных растворах неустойчив и равновесие комплексообразования смещено влево в сторону образования розового аквокомплекса кобальта (II). Поэтому реакцию проводят при избытке тиоцианат - ионов, чтобы сместить равновесие вправо. Равновесие смещается вправо также в водно - ацетоновых растворах, в силу чего реакцию иногда проводят в водно - ацетоновой среде (ацетон хорошо смешивается с водой).
В растворах органических раств'орителей (изоамиловый спирт, эфир) устойчивость комплекса повышается, поэтому при проведении данной реакции водный раствор, содержащий катионы Со2+, смешивают с небольшим количеством органического растворителя (смесь изоамилового спирта и диэтилового эфира). При этом [Co(NCS)4] + переходит в органическую фазу и окрашивает ее в синий цвет. Проведению реакции мешают катионы Fe3+; Cu2+, также образующие окрашенные ■ соединения с тиоцианат - ионами - желто-бурый комплекс меди (II) и красные комплексы железа (III). Мешающее действие катионов Fe3+ устраняют связывая их в устойчивые бесцветные комплексы такими маскирующими агентами, как фторид - и тартрат -анионы, прибавляя NaF и NaKC4H4O6 соответственно.
5.Реакция с сульфид - ионами.
Со2+ + S2- = CoS (черный)
Осадок CoS растворяется в минеральных кислотах, однако при стоянии он превращается в форму, трудно растворимую в разбавленной НС1, но растворимую в кислотах в присутствии окислителей.
