Качественный анализ (кислотно-основная классификация)
Наличие щелочи способствует смещению равновесия вправо вследствие связывания выделяющихся ионов водорода в молекуле воды. 6. Реакция образования -зелени Ринмана-.
Zn(NO3)2+ Co(N03)2 —t-> CoZn02 (зеленый) + 4 NO2 +О2.
-Зелень Ринмана- - смешанный оксид кобальта и цинка CoZnO2 зеленого цвета.
Другие реакции катионов цинка.
Катионы Zn2+ при взаимодействии с различными другими реактивами образуют осадки: с Na2HPO4 - белый Zn3(PO4)2 (растворяется в кислотах и в аммиаке); с К2Сг04 -желтый ZnCrO4 (растворяется в кислотах и щелочах); с СоС12 и (NH4)2[Hg (SCN)4] -голубой ZnCo[Hg (SCN)4]; а также с различными орг. реагентами.
Аналитические реакции катиона алюминия Al3+
1. Реакция с щелочами:
А13+ + 3 ОН- -► А1(ОН)3 (белый)
А1(ОН)3 + 3 ОН- -> [А1(ОН)6]3-
После растворения гидроксида алюминия и образования гидроксокомплексов алюминия к раствору прибавляют несколько кристаллов соли аммония (NH4C1). Смесь нагревают. Гидроксокомплексы разрушаются выпадает осадок А1(ОН)3:
[А1(ОН)6]3- + 3 NH4+ -> А1(ОН)3 + 3 NH3 + 3 Н2О
Наиболее полное осаждение гидроксида алюминия происходит при рН- 5-6. Осадок А1(ОН)3 растворяется в кислотах, но не растворяется в аммиаке.
2. Реакция с аммиаком.
А13+ + 3 NHrH2O -> А1(ОН)31 (белый аморфный) + 3 NH4+
3. Реакция с нитратом кобальта - образование -тенаровой сини- (фармакопейная).
-Тенаровая синь- - смешанный оксид алюминия и кобальта синего цвета.
2 A12(SO4)3 + 2 Co(NO3)2 —tT-> 2 Со(А1О2)2 + 4 NO2 + 6 SO3 + O2.
4. Реакция с алюминоном
Катионы А13+ при взаимодействии с алюминоном – аммонийной солью ауринтрикарбоновой кислоты (для кратности NH4L) образуют в уксуснокислой или аммиачной среде комплекс красного цвета (по-видимому, состав A1(ОН)2 L. Точное строение комплекса неизвестно. Выпадает красный хлопьевидный осадок. Мешают катионы Са2+, Cr3+, Fe3+
5. Реакция с ализарином (1,2 - диоксиантрахинон).
Катионы А13+ с ализарином и его производными в аммиачной среде образует комплексы ярко красного цвета называемые -алюминиевыми лаками-.
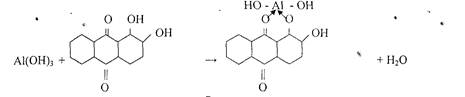
Комплекс устойчив в уксусной среде. Реакция высокочувствительна: предел обнаружения 0,5 мкг. Мешают катионы: Zn2+, Sn(II), Cr3+, Mn2+, Fe3+ и др.
Другие реакции катиона алюминия А13+.
Катионы А13+ образуют также осадки при реакциях в растворах: с Na2HPO4 - белый А13РО4, с CH3COONa- белый СН3СООА1(ОН)2, с оксихинолином (кратко Нох) - желто-зеленый [А1(О)3] и др.
Аналитические реакции катиона олова (II)
1. Реакция с щелочами: Sn2+ + 2 ОН- - Sn(OH)2 |(белый)
Sn(OH)2 + 2 ОН-= [Sn(OH)4]2'.
2. Реакция с аммиаком: Sn2+ + 2 NH3-H2O) — Sn(OH)2 (белый) + 2 NH4CI
Осадок не растворяется в избытке аммиака.
3. Реакция с сульфид - ионами:8Sn2+ + S2- — SnS . (бурый)
Осадок не растворяется в щелочах, в избытке раствора сульфида натрия
4. Реакция с солями висмута (III).Олово (II) является хорошим восстановителем:
2 Bi3+ + 3 [Sn(OH)4]2- + 6 ОН- — 2 Bi + 3 [Sn(OH)6]2-
5. Реакция с хлоридом ртути(П): [SnCl4]2-+ 2 HgCI2 -+ Hg2Cl2 J. + [SnCl6]2-
Выпадает белый осадок каломели Hg2Cl2, который постепенно чернеет за счет выделяющейся металлической ртути: [SnCl4] -+ Hg2Cb —> 2 Hg + [SnCl6]
Другие реакции олова (II).
Соединения олова (II) при взаимодействии с молибдатом аммония образуют так называемую -молибденовую синь- (раствор окрашивается в синий цвет); с Na2HPO4 дают белый осадок Sri3(PO4)2 (растворяется в кислотах и щелочах); при реакции с FeCI3 восстанавливают железо (III) до железа (II), причем в присутствии гексацианоферрата (III) калия K3[Fe(CN)6] раствор сразу же окрашивается в синий цвет вследствие образования турибуллевой сини.
Аналитические реакции олова (IV)
Олово (IV) обычно открывают, предварительно восстановив его металлическим железом, магнием, алюминием и т.д. до олова (II). Затем проводят реакции, характерные для олова (II), как описано в предыдущем разделе.
1. Реакция олова (IV), с щелочами:
Sn4+ + 4 ОН- = Sn(ОН)4 (белый)
Осадок растворяется в избытке р-ра щелочи с образованием гидрокомплексов.
Sn(ОН)4 + 2 ОН- =[Sn(ОН)6]2-
2. Реакция с сульфид ионами: Н2[SnCl6] + 2Н2S = Sn S2 (желтый) + 6 НCl
Выпадает желтый осадок сульфида олова (IV), который в отличие от сульфида олова (II), растворяется в избытке(NH4)2S или Nа2S с образованием тиосолей.
SnS2+ (NH4)2S = (NH4)2SnS3.
3. Реакция восстановления олова (IV) до олова (II):
[SnCl6]2-+ Fe -> [SnCl4]2-+Fe2++ 2 Cl-.
Олово (II). полученное после восстановления олова (IV), открывают реакциями с солями висмута (III), с хлоридом ртути (II).
Другие реакции олова (IV).
С рядом органических реагентов олово (IV) образует окрашенные или • малорастворимые комплексы. С хлоридами рубидия и цезия олово (IV) образует малораетворимые комплексные соли состава Rb2[SnCl6] и Cs2[SnCls].
Аналитические реакции мышьяка (III) и мышьяка (V)
Мышьяк (III) и мышьяк (V) обычно открывают в виде арсенит - иона AsO3 3- и арсенат - ионов AsO3- соответственно, т.е. в форме анионов, а не в форме катионов. Поэтому реакшш этих анионов описаны при рассмотрении аналитических реакций анионов. Аналитические реакции катиона хрома (III) Cr3+.
1. Реакции с щелочами и с аммиаком.
Сг3+ + 3 ОН- Сг(ОН)3 (серо-зеленый или сине-фиолетовый) Сг3+ + 3 NH3-H2O -> Сг(ОН)3 | + 3 NH4+.
При прибавлении раствора NaOH и перемешивании, осадок растворяется с образованием раствора зеленого цвета. Добавление раствора аммиака приводит лишь к частичному растворению осадка (раствор становится фиолетовым). Осадок Сг(ОН)3, обладающий амфотерными свойствами, растворяется как в щелочах, так и в кислотах: Сг(ОН)3 + 3 ОН- ->• [Сг(ОН)6]3',
Сг(ОН)3 + 3 НС1 +3 Н2О — [Сг(Н2О)6]3+ + 3 С1-.
В растворе аммиака гидроксид хрома (III) растворяется лишь частично с образованием фиолетового комплекса [Cr(NH3)6]3+:
Сг(ОН)3.+ 6 NH3-H2O — [Cr(NH3)6]3+ + 3 ОН- + б Н2О
2. Реакции окисления катионов хрома (III) до хромат - ионов и дихромат — ионов.
а) Окисление пероксидом водорода. Проводят обычно в щелочной среде при нагревании: 2 [Сг(ОН)6]3- + 3 Н2О2 = 2 Сг О42-+ 2 ОН- + 8 Н2О
Изменение зеленой окраски раствора (цвет [Сг(Н2О)б]3+) на желтую (цвет СгО4-).
б) Окисление персульфатом аммония. Проводят в кислой среде в присутствии катализатора - солей серебра (I) (AgNO3).
2 Сг3+ + 3 S2O82- + 7 Н2О -> Сг2О72- + 6 SO42- + 14 Н+. Раствор принимает желто - оранжевую окраску (цвет дихромат - ионов Сг2О7-).
в) Окисление перманганатом калия КМпО4.
10 Сг3+ + 6 МпО4-+ 11 Н2О -> 5 СьО72' + 6 Мп2+ + 22 Н+. При прибавлении избытка КМпО4 выпадает бурый осадок МпО(ОН)2. Окисление марганца (И): 2 МпО4-+ 3 Мп2++ 7 Н2О ->• 5 МпО(ОН)2+ 2 Н+ Увеличение кислотности среды препятствует образованию осадка МпО(ОН)2.
3. Реакция образования надхромовой кислоты: 2СгО42- + 2 Н+ —> Сг2О72- + Н2О
Сг2О72- +4 Н2О + 2 Н+= 2 Н2 СгО6 + 3Н2О
