Качественный анализ (кислотно-основная классификация)
6.Реакция с солями цинка - образование -зелени Ринмана-.
Zn(NO3)2 + Co(NO3)2 -> CoZnO, + 4 NO, + O2
Образуется зола зеленого цвета.
7.Реакция с реактивом Ильинского (1-нитрозо-2-нафтол).
Реакцию проводят в нейтральной или слабо кислой среде. 1-нитрозо-2-нафтол в растворе может существовать в двух таутомерных формах, условно обозначаемых через HL:
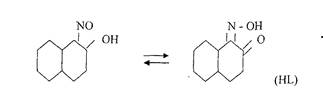
В этой реакции вначале кобальт (II) окисляется до кобальт (III), который с 1-нитрозо-2-нафтолом образует внутрикомплексное соединение, выделяющееся в виде пурпурно-красного осадка:
Co3++3HL->CoL3 + 3H+
Реакцию проводят в кислой среде при нагревании. В кислой среде кобальт (II) окисляется до кобальта (III), а проследний взаимодействует с НL и образует внутрикомплексное соединение состава СоL3
Со3+ + 3 НL- = СоL3 (красный) + 3 Н+
9. Другие реакции катионов кобальта (II)
Катионы кобальта Со2+ с нитритом калия KNO2 в уксуснокислой среде образуют (после окисления до Со3+) желтый кристаллический осадок гексанитрокобальтата (III) калия K3[Co(NO2)6]; по этой реакции катионы кобальта можно открыть в присутствии катионов никеля.
Соединение Со2+ с бурой Na2B4O710H2O образуют перлы синего цвета, с рубеановодородной кислотой NH2CSCSNHj - желто-бурый осадок комплексного соединения.
Аналитические реакции катиона никеля (II) Ni2+
Аквокомплексы никеля (II)[Ni(H2O)6]2+ окрашены в зеленый цвет, поэтому водные растворы солей никеля (II) имеют зеленую окраску. В растворе никель (II) присутствует только в форме комплексных соединений.
1.Реакция с щелочами.
Ni2+ + 2 ОН- -> Ni (ОН)2(зеленый)
Проба на растворимость. Осадок Ni(OH)2 растворяется в растворах кислот и аммиака: Ni(OH)2 + 2 Н+ -• №2+ + 2 Н2О
Ni(OH)2 +6 NH3 — [Ni(NH3)6]2+ + 3 ОН-
2.Реакция с аммиаком.
Ni(NO3)2 + NH3H2O — NiOHNO3 + NH4NO3,
NiCl2 + NH3H2O -- NiOHCl + NH4C1 2NiSO4 + 2 NH3H2O -- Ni(OH)2SO4 + (NH4)SO4,
Методика. В пробирку вносят 2-3 капли раствора соли хлорида никеля (II) Добавляют концентрированный (25%-й) раствор аммиака до полного растворения осадка и образования раствора синего цвета:
NiOHCl + 6 NH3 -> [Ni(NH3)6]2+ + ОН- + CY
Оксисоль Ni(II)гексамминникель (II) катион
Прибавляют к ней по каплям концентрированный раствор КВг до выпадения фиолетового осадка [Ni(NH3)6]Br2.
Комплексы [Ni(NH3)6]Ck [Ni(NH3)6](NO2)2, [Ni(NH3)6]SO4 хорошо растворяются в воде, а остальные мало растворимы в воде.
3.Реакция с реактивом Чугаева (диметилглиоксимом).
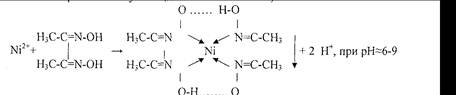
Розово-красный Бис-диметилглиоксиматоникель (II)
Реакцию проводят в среде аммиака.
Осадок растворяется в сильных кислотах и щелочах, нерастворим в растворах аммиака. Проведению реакции мешают катионы Cu2+, Pb2+, Fe2+, Fe3+.
Чувствительность реакции повышается в присутствии небольших количеств окислителей (бром, йод и др.), переводящих Ni (II) в Ni (III), комплекс которого имеет еще более интенсивную окраску.
4.Реакция с сульфид - ионами. -
Ni2+ + S2- -> NiS (черный)
5.Другие реакции катионов Ni (II).
Катионы Ni2+ с тиоцианатом калия KNCS и пиридином (Ру) образуют голубой осадок-комплекса состава [NiPy](NCS)2; со смесью щелочи и хлорной воды - черно-бурый осадок гидроксида Ni (III) Ni(OH)3; с рубеановодородной кислотой -сине-фиолетовый осадок рубеаната никеля малорастворимый в кислотах и аммиаке.
Аналитические реакции катиона ртути (II) Hg2+
Ионы ртути (II) [Hg(H2O)2+ в водных растворах бесцветны. Все соединения ртути (II) сильно ядовиты, поэтому при работе с ними следует принимать меры предосторожности!
1.Реакция с щелочами (фармакопейная).
Hg2+ + 2 ОН- -> Hg О|(желтый) + Н2О
Осадок HgO растворяется в азотной кислоте, в растворах хлоридов и иодидов щелочных металлов с образованием соответственно Hg(NO3)2. HgCl2 и комплекса [Hgl4f:
HgO + 2 HNO3 — Hg(NO3)2 + H2O
HgO +2 Cl- + H2O - HgCl, + 2 OH-
HgO +4 Г + H2O - [Hgl4]2- + 2 OH-
2.Реакция с аммиаком.
HgCl2 + 2 NH3 — HgNH2CL6елый) + NH4C1 2 Hg(NO3)2 + 4 NH3 + H2O --[OHg2NH2]NO3 (белый) + 3 NH4NO3
Осадки растворяются (лучше - при нагревании) в избытке аммиака; но только в присутствии солей аммония, с образованием бесцветного комплексного катиона гетрамминртути (II) [Hg(NH3)4]2+.
1 После выпадения осадков в пробирки добавляют по 3-4 капли водного раствора соли аммония (NH4C1 или NH4NO3) и по каплям - водный раствор аммиака при перемешивании до полного растворения осадков:
HgNH2Cl + 2 NH3 + NH4+ -+ [Hg(NH3)4]2+ + СГ |OHg2NH,]NO2 + 4 NH3 +3 NH4+ — 2 [Hg(NH3)4]2+ +NO3- + H2O
3.Реакция с иодидом калия (фармакопейная).
Hg2+ + 2 Г ■— Hgbi(KpacHufi) Hgl2 + 21-^ [Hgl4]2- (бесцветный)
Доведению реакции мешают катионы Pb2+, Cu2+, Ag+, Bi(III), а также окислители. Капельный метод рекомендуется для открытия Hg2+ даже в присутствии мешающих катионов.
4.Реакция с сульфид - ионами (фармакопейная).
Реакция протекает в несколько стадий. Вначале образуется белый осадок, постепенно изменяющий окраску через желто - красную и бурую на коричнево-черную при избытке сульфид - ионов.
3 HgCl, + 2 H2S — 2 HgSHgCl2 + 4 НС1
2 HgS-HgCl2 + H2S •— 3 HgS (коричнево-черный) + 2 HC1
Аналогично протекают реакции HgCl2 с сульфидом натрия Na2S.
Выпадает белый осадок, чернеющий при дальнейшем прибавлении Na2S или HgS, H2S не растворяется в разбавленной азотной кислоте, но растворим в царской водке (смесь НС1 + НNО3)
3 HgS +6 HC1 + 2 HNO3 — 3 HgCl2 + 2 NO + 3S + 4 H2O
5.Реакция с хлоридом олова (II).
Катионы Hg2+ восстанавливается олово (II) вначале до Hg22+, а затем - до металлической ртути Hg°.
2 Hg2+ + [SnCl4]2- + 4 СГ — Нё2С12|(белый) + [SnCl6f - Hg2Cl2 + [SnCl4f — 2 Hg° (темный) + [SnCl6f Выпадает белый осадок Hg2Cl2, который постепенно'темнеет.- Проведению реакции мешают катионы Ag2+, Hg22, Sb(III), Bi(III). t
6.Реакция с металлической медью.
Катионы Hg2+ восстанавливаются металлической медью до металлической ртути. Hg2+ + Си0 -> Hg° (темный) + Си2+
Методика. На медную поверхность наносят каплю раствора соли ртути (II). На поверхности возникает темное пятно, которое при протирании фильтровальной бумагой становится серебристо-блестящим.
7.Реакция с хромат - ионами.
Hg2+ + СгО42' —>СгО4(желтый)
8.Другие реакции катионов ртути (II).
Катионы Hg2+ с ортофосфат - ионами образуют белый осадок Hg3(PO4)2; с дифенилкарбазидом и дифенилкарбазоном - комплекс сине-фиолетового цвета; с дитизоном - желто-оранжевый или красный комплекс, в зависимости от условий проведения реакции.
Аналитические реакции анионов первой аналитической группы: SO42-, SO32-, S2O32-, С2О42-, СО32-, В4О72-(ВО2), РО43-, AsO43-, АsОз3-, F-
Групповой реагент - водный раствор ВаС12. Реакции с групповым реагентом проводят в нейтральной или слабо щелочной среде, так как осадки соответствующих бариевых солей малорастворимы в данных условиях. Осадки бариевых солей анионов I группы растворяются в минеральных кислотах, за исключением BaSO4.
