Обозначение констант равновесия межлигандного обмена хелатных комплексов экстрационно-фотометрическим методом
Реакции типа (1.2), в которых второй комплекс является поставщиком лиганда L-, не имеют преимуществ по сравнению с реакциями (1.1) и их использование более целесообразно при введении других металлов, конкурирующих при комплексообразовании с одним лигандом, как описано в [5].
2 Эксперементальная часть
2.1 Реагенты и средства измерений
При выполнении работы использовались следующие химические реактивы:
– кислота азотная по ГОСТ 4461-77, хч;
– натрий тетраборнокислый, 10-водный по ТУ 6-09-3970-75 о.с.ч. 3 – 4;
– хлороформ;
– спирт этиловый ректификованный технический;
– 1-(2-пиридилазо)-2-нафтол, Reanal, для комплексонометрии;
– 8-оксихинолин.
Водные растворы реагентов готовили на дистиллированной воде; боратный буферный раствор (![]() ) готовили растворением десятиводного тетрабората натрия в воде (9,56 г на 0,5 л раствора); исходные (стандартные) растворы Ni(II) и Cu(II) готовили из чистых металлов с содержанием примесей не более 0,1 %, растворением в концентрированной азотной кислоте.
) готовили растворением десятиводного тетрабората натрия в воде (9,56 г на 0,5 л раствора); исходные (стандартные) растворы Ni(II) и Cu(II) готовили из чистых металлов с содержанием примесей не более 0,1 %, растворением в концентрированной азотной кислоте.
Растворитель: хлороформ (перегнанный один раз).
Измерения проводили на фотометре КФК-3 с длинной кюветы 1 см.
2.2 Экстракционные хелатные системы
В данной работе были использованы экстракционные системы на основе 1-(2-пиридилазо)-2-нафтола, их отличие друг от друга заключалось только в том, что данный реагент образовывал хелаты с разными металлами; поэтому, здесь будет уместно рассмотреть обобщенную характеристику данных систем, которая представлена ниже.
2.2.1 1-(2-Пиридилазо)-2-нафтол
1-(2-Пиридилазо)-2-нафтол (PAN) представляет собой оранжево красный аморфный порошок (мол. вес 249,25; т. пл. 137°С), почти нерастворимый в воде, но растворимый в концентрированных щелочах (образование растворимых солей щелочных металлов) и многих органических растворителях, которым он предает желтую окраску [10]. В этой работе применялся его раствор в этиловом спирте (![]() ). Максимум светопоглощения реагента в хлороформе находится приблизительно при 470 ммк; при длинах волн больше 560 ммк реагент практически не поглощает.
). Максимум светопоглощения реагента в хлороформе находится приблизительно при 470 ммк; при длинах волн больше 560 ммк реагент практически не поглощает.
В кислых растворах 1-(2-пиридилазо)-2-нафтолприсоединяет ион водорода (![]() ), в щелочных растворах он диссоциирует как кислота (
), в щелочных растворах он диссоциирует как кислота (![]() ). Константа распределения нейтрального реагента между хлороформом и водной фазами равна 2,5∙105. Реагент достаточно устойчив к действию окислителей [10]. Относится к хелатам с 5-членными циклами [1].
). Константа распределения нейтрального реагента между хлороформом и водной фазами равна 2,5∙105. Реагент достаточно устойчив к действию окислителей [10]. Относится к хелатам с 5-членными циклами [1].
Таблица 2 Экстракция 1-(2-пиридилазо)-2-нафтолатов Ni(II) и Cu(II)
|
Металл |
Оптимальные условия экстракции |
|
Cu(II) |
Комплекс меди (примерный состав Cu(PAN)2) экстрагируется хлороформом при |
|
Ni(II) |
Никель при комнатной температуре реагирует с PAN медленно, но при нагревании до 80°С при |
2.2.2 8-Оксихинолин (оксин)
Так как в экстракте происходит обмен PAN на 8-оксихинолин, то полезно представить сведения и о последнем.
8-Оксихинолин (мол. вес 145,15; т. пл. 75 – 76°С), известный также под тривиальным названием оксин, кристаллизуется из смеси воды и спирта в виде почти бесцветных игл. Он слабо растворим в холодной воде (3,6∙10-3 ![]() при 20 – 25°С), но легко растворяется в минеральных кислотах и разбавленных щелочах с образованием желтых растворов. Увеличение растворимости в кислотных растворах вызвано образованием ионов оксихинолиния H2Ox+; в щелочных растворах образуются оксинат-ионы Ox- [10]. Как и 1-(2-пиридилазо)-2-нафтол, относится к хелатам с 5-членными циклами [1].
при 20 – 25°С), но легко растворяется в минеральных кислотах и разбавленных щелочах с образованием желтых растворов. Увеличение растворимости в кислотных растворах вызвано образованием ионов оксихинолиния H2Ox+; в щелочных растворах образуются оксинат-ионы Ox- [10]. Как и 1-(2-пиридилазо)-2-нафтол, относится к хелатам с 5-членными циклами [1].
При 25°С и ионной силе 0,1 для оксина найдены следующие константы [10]:ъ
![]() ;
;
![]() .
.
Следует отметить, что реагент очень чувствителен к свету, и его следует хранить в темной посуде.
Оксин легко растворим в хлороформе и других органических растворителях. Поглощает при 318 ммк; выше 375 ммк поглощает довольно слабо [10]
В работе использовались растворы 8-оксихинолина в хлороформе с такими концентрациями: 1-ая серия измерений ![]() ; 2-ая серия измерений
; 2-ая серия измерений ![]() .
.
Примерный состав оксинатов меди и никеля имеет вид Me(Ox)2 [10]. Эти соединения растворимы в хлороформе
2.3 Обмен лигандами в экстрактах комплексов Ni(II) и Cu(II) с PAN на оксинат
В работе поставлена задача изучить обмен в экстрактах комплексов Ni(II) и Cu(II) с PAN при добавлении разных концентраций 8-оксихинолина. Полноту обмена изучали добавлением в экстракт панатов указанных металлов разных количеств оксина. Спектры поглощения комплексов с PAN практически не накладываются на поглощение PAN, оксина и оксинатов, поэтому обмен удобно наблюдать по измерению светопоглощения комплексов PAN с ионами металлов. Спектры поглощения комплексов металлов (Ni(II) и Cu(II)) с PAN в CHCl3 приведены на рисунке 2.1, а численные значения ε (молярный коэффициент поглощения) приводились в предыдущих подразделах.
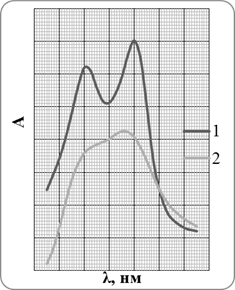
Рисунок 2.1. Спектры поглощения панатов Ni – 1 и Cu – 2
Было проведено две серии измерений с концентрациями оксина, которые различались на порядок.
Результаты первой и второй серий были занесены в таблицу 3 и приложение А соответственно. Результаты второй серии для меди вынесены в приложение (через большой избыток оксина идет полное разрушение), но они полезны тем, что для паната меди установлено погрешность измерения – светопоглощение A2; с учетом этого представлены результаты первой серии.
Таблица 3 Первая серия измерений. Светопоглощение экстрактов комплексов металлов в CHCl3 при добавлении разных концентраций оксихинолина. A0 – без добавления оксина, A1 – ![]() ; A2 –
; A2 – ![]() ; A3 –
; A3 – ![]() ;
; ![]()
|
λ, нм |
A0 |
A1 |
A2 |
A3 |
|
Ni(PAN)2 +Ox; | ||||
|
570 |
0,507 |
0,488 |
0,487 |
0,486 |
|
Cu(PAN)2 +Ox; | ||||
|
560 |
0,326 |
0,180 |
0,125 |
0,074 |
