Пептиды и первичная структура белка
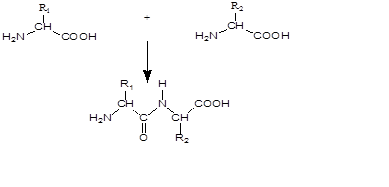
Рис.4 Основной принцип пептидного синтеза
Образование пептидной связи в мягких условиях удается лишь при активировании карбоксильного компонента одной из аминокислот, вступающей в реакцию (рис. 5).
Вторая аминокислота В (аминокомпонент) атакует активированный карбоксильный компонент аминогруппой с образованием пептидной связи. Незащищенная аминофункция карбоксильного компонента А тоже может реагировать, что приводит (рис. 5) к нежелательным побочным продуктам — линейным и циклическим пептидам. Из этого следует вывод, что для однозначного течения пептидного синтеза следует временно блокировать все функциональные группы, не участвующие в образовании пептидной связи[3].
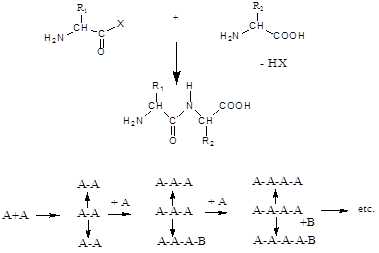
Рис.5 Схема образования пептидной связи без защиты не участвующих в реакции функциональных групп
Пептидный синтез, т. е. образование каждой пептидной связи, является поэтому многоступенчатым процессом. В первую очередь получают частично замещенные аминокислоты, при этом они одновременно теряют цвиттер-ионную структуру. Вторая ступень, собственно образование пептидной связи, протекает в две стадии. Сначала нужно активировать N-защищенный карбоксильный компонент. Затем происходит собственно образование пептидной связи, которое протекает либо одноступенчато (вместе с активированием), либо последовательно в следующую стадию. На третьей ступени защитные группы селективно отщепляются, причем полученные частично защищенные производные дипептидов могут использоваться для дальнейших синтезов как карбоксильные или аминокомпоненты. Само собой разумеется, что в случае синтеза дипептида обе защитные группы удаляются одновременно. Пептидный синтез, далее, усложняется еще и тем, что из 20 протеиногенных аминокислот 9 обладают еще третьей функциональной группой, которая также требует селективной защиты. Это Ser, Thr, Туг, Asp, Glu, Lys, Arg, His и Cys. Следует различать временные и постоянные защитные группы. Временные защитные группы служат для защиты концевых амино- и карбоксильных групп и должны поэтому селективно отщепляться в присутствии постоянных защитных групп. Постоянные защитные группы удаляются обычно только после окончания синтеза пептида или же иногда на стадии промежуточного продукта. Активирование карбоксильного компонента и следующее за ним образование пептидной связи, т. е. так называемая реакция конденсации, в идеальных условиях должны протекать с высокой скоростью без рацемизации, без побочных реакций и с высоким выходом при соединении эквимолярных количеств карбокси- и аминокомпонентов. К сожалению, в настоящее время еще неизвестно такого метода конденсации, который удовлетворял бы всем этим требованиям. Приходится выбирать из относительно большого набора методов подходящие варианты в соответствии со специфическими целями синтеза. Решение зависит в каждом случае от выбранной тактики синтеза, в соответствии с которой для каждого отрезка синтезируемой последовательности подбираются оптимальные методы конденсации. Набор методов, которые применяются для практического проведения синтеза пептидов, относительно мал по сравнению с примерно 130 описанными методами синтеза. На последней ступени пептидного синтеза происходит отщепление защитных групп. Поскольку синтез дипептида с полным удалением защитных групп проводится довольно редко, гораздо большее значение имеет селективное деблокирование, т. е. выборочное отщепление защитных групп N-концевой аминофункции или же С-концевой карбоксильной группы. Этот вопрос находится в тесной связи с общим планом синтеза.
Под стратегией понимают последовательность связывания аминокислотных компонентов в пептид, причем следует различать постепенное наращивание и фрагментную конденсацию. Получение полипептидов путем постепенного наращивания цепи трудноосуществимо при больших размерах целевой молекулы. В этих случаях большое значение приобретает разделение объекта синтеза на отдельные фрагменты с последующим соединением их в полипептид. Оптимальный выбор комбинации защитных групп и применение подходящего метода конденсации для каждого отрезка составляет предмет тактики пептидного синтеза.
Стратегическую модификацию постепенного наращивания пептидов или белков представляет разработанный в 1963 г. Меррифилдом пептидный синтез на полимерных носителях. Несмотря на сенсационный успех этого метода (синтез протекает в двухфазной системе и есть возможиость его автоматизации), возлагаемые на него большие ожидания до сих пор полностью не исполнились.
1.4 Экспериментальные методы создания пептидной связи
|
|
|
|
Образование пептидной связи в общем сводится к отщеплению элементов воды.
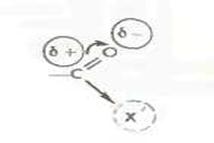
Для того чтобы сделать эту реакцию возможной и, более того, обеспечить ее высокую скорость и полноту, необходимо «активировать» карбоксильную группу. Такая активация должна сводиться к увеличению электрофильности карбонильного углерода[4].
Как легко видеть, важная роль в этом случае принадлежит группе X', которая в конечном счете определяет эффективность активации. Методы конденсации обычно и различаются природой группы X'.
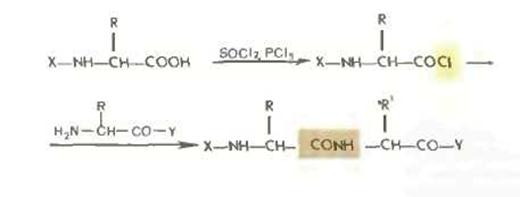
Хлорангидридный метод.
Хлорангидридный метод, упоминавшийся в историческом очерке, в настоящее время применяется редко, так как сопровождается рацемизацией и образованием побочных продуктов. Хлорангидриды получаются обычно обработкой производных аминокислот и пептидов хлористым тионилом или пятихлористым фосфором.
пептид молекула белок аминокислота
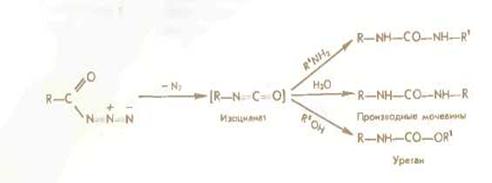
Азидный метод.
Метод Т. Курциуса находит широкое применение в синтезе пептидов.
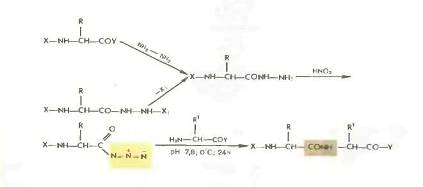
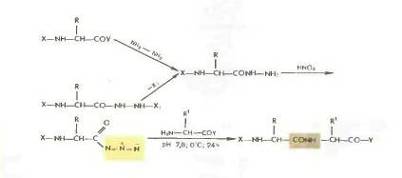
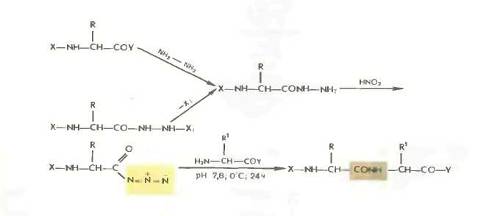
Гидразиды получаются либо прямым гндразинолизом эфиров защищенных аминокислот или пептидов, либо из защищенных гидразидов (—СО— NH — NH— Z—, - СО—NH и т. д.). Перевод в азиды осуществляется обработкой водным раствором нитрита натрия в кислой среде при —5 °С или действием изоамилнитрита или третбутил нитрита при —20 0 С в органическом растворителе (модификация Хонцля и Рудингера 1961). Азиды можно получать и непосредственно из НООС-производных с помощью днфенилфосфорилазида N3PO(OC2H5)z. применяемого в качестве конденсирующего агента (в частности, для получения циклопептидов).
Азидный метод не свободен от недостатков Основная побочная реакция — перегруппировка Курциуса: