Пептиды и первичная структура белка
Направление и степень протекания этой перегруппировки определяется структурой азида и условиями реакции. Хотя при азидной конденсации рацемизация сведена к минимуму, ее нельзя не учитывать, особенно при блочном синтезе; в качестве основания рекомендуется использовать не триэтиламин-. а N-метилморфолин или N -этилдиизопропиламин.
Метод ангидридов.
Симметричные ангидриды ациламинокислот легко получаются обработкой последних дициклогексенкарбодиимидом или этоксиацетиленом например:
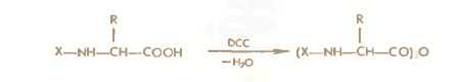
При реакции с аминокомпонентом образуются пептиды
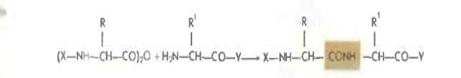
Метод в последнее время используется в твердофазном синтезе.
Более распространенным является применение смешанных ангидридов, в частности с производными угольной кислоты, получаемых с помощью изобутилхлоркарбоната (Р. Воган 1951).
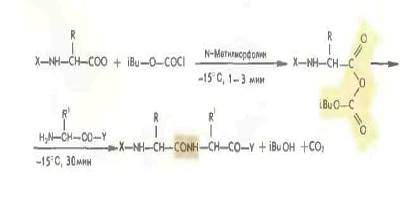
Быстрый ступенчатый метод синтеза пептидов с использованием избытка смешанных ангидридов носит название REMA-синтеза. К этой группе методов можно отнести и синтез пептидов с применением в качестве конденсирующего средства 1-этоксикарбо иил-2-этокси-1,2-дигидрохинолина.
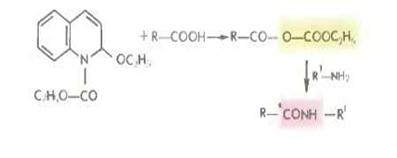
Перспективны также смешанные ангидриды на основе производных ацилоксифосфония получае мые с помощью дифен ил фосфор ил хлорида (C2H5O)2POCl, тетра-этилпирофосфита (C2Р5O)2РООРО (OC2H5)2 или дифенилфос-фини хлорида (С Н ) РОС1 Основные побочные процессы при их использовании — это образование уретанов или оксазолонов и диспропорционирование
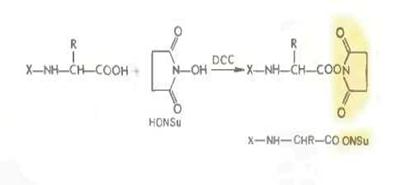
Метод активированных эфиров. Среди арильных активированных эфиров наиболее широки используются п- нитрофениловые (—ONр) (М. Боданскии 1956), 2,4 динитрофениловые, о-нит-рофениловые и о-нитротиофениловые, 2,4*5 трихлорфениловые (—ОТср), пентахлорфениловые (—ОРср). Особое значение приобрели недавно предложенные Л. Кишфалуди высокореакционноспособные пентафторфениловые эфиры (—OPfp). Ариловые эфиры этих типов получаются обычно из соответствующих фенолов с помощью карбодиимида.
В последние годы большое распространение получили активированные эфиры на основе производных гидроксиламина и прежде всего N- гидроксисукцинимидные эфиры, например:
1.5 Первичная структура белка
В конце 50-х-начале 60-х годов было обнаружено, что последовательность аминокислот в белках детерминирована генетически. Последовательность нуклеотидов в ДНК-веществе наследственности определяет комплементарную последовательность нуклеотидов в РНК, а последняя в свою очередь определяет последовательность аминокислот в белке. Более того, синтез всех белков из соответствующих аминокислот имеет единый механизм.
Определение последовательности аминокислот в белках представляет интерес по четырем причинам. Во-первых, такие данные имеют большое значение для выяснения молекулярной основы биологической активности белка. Сведения о последовательности аминокислот приобретают особую ценность при их сопоставлении с другими химическими и физическими характеристиками. Во-вторых, изучение последовательности аминокислот в сочетании с детальным анализом пространственной структуры необходимо для выяснения тех принципов, на основе которых из полипептидных цепей формируются высокоспецифичные трехмерные формы. При этом последовательность аминокислот в белке служит связующим звеном между генетической информацией, заложенной в ДНК, и трехмерной структурой белка, лежащей в основе его биологической активности. В-третьих, изменения в последовательности аминокислот могут привести к нарушению нормальной функции белка, а следовательно, и к соответствующей болезни. В частности, такая тяжелая болезнь, как серповидно-клеточная анемия, нередко приводящая к легальному исходу, возникает в результате замены всею лишь одной-единственной аминокислоты в одном-единственном белке. Таким образом, определение последовательности аминокислот относится к новой области медицины -молекулярной патологии. В-четвертых, данные о последовательности аминокислот в белке могут многое рассказать о его эволюции. Дело в том, что в неродственных белках эти последовательности совершенно различны. Белки лишь в том случае имеют сходную последовательность аминокислот, если они происходят от общего белка-предшественника, Следовательно, изучение последовательностей аминокислот в белках позволяет проследить эволюцию на молекулярном уровне.
1.6 Экспериментальное определение первичной структуры белка
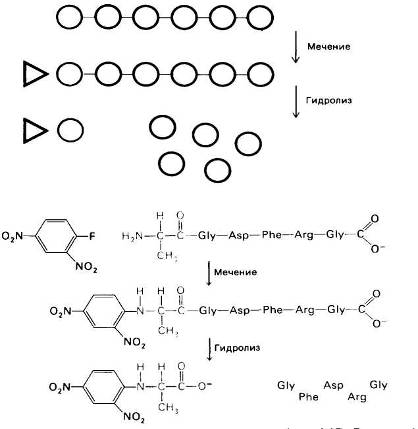
Рассмотрим, как можно определить последовательность аминокислот в коротком пептиде. Допустим, что пептид состоит из 6 аминокислотных остатков, расположенных в следующей последовательности:
Ala-Cly-Asp-Phe-Arg-Gly.
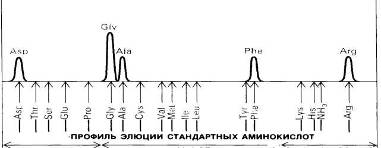
(Для обозначения аминокислот использованы общепринятые сокращения). Прежде всего необходимо определить аминокислотный состав пептида. Для этого его гидролизуют до составляющих аминокислот нагреванием до 110°С в течение 24 ч в 6 н. НС1. Далее аминокислоты полученного гидролиза разделяют методом ионообменной хроматографии на колонке с сульфонированным полистиролом. Фракционированные аминокислоты определяют по окраске, образующейся при нагревании с нингидрином: α-аминокислоты дают с нигидрином интенсивное синее окрашивание, а иминокислоты, например пролин, желтое[5].
Рис. 17 нингидрин и флуорескамин
Метод ионообменной хроматографии обладает высокой чувствительностью:
|
|
рН 3,25 0,2 м Цитрат натрия
рН 4,25 0(2 м Цитрат натрия
рН 5,28 0,35 м Цитрат натрия
Рис.18 Элюция из колонки
С его помощью можно определить даже один микрограмм аминокислоты, т.е. примерно столько, сколько содержится в одном отпечатке пальца. Количество аминокислоты пропорционально оптической плотности раствора после нагревания с нингидринйм. Если требуется определить еще меньшие количества аминокислоты- порядка нескольких нанограммов, то используют флуорескамин, который реагирует с α-аминогруппой, образуя сильно флуоресцирующее соединение. О природе аминокислоты судят по объему элюции, т.е. по объему буфера, использованному для вымывания данной аминокислоты с колонки (рис. ). Сравнение результатов хроматографии гидролизата со стандартной смесью аминокислот свидетельствует о том, что исследуемый пептид имеет следующий аминокислотный состав:
(Ala, Arg, Asp, Gly2, Phe).
Скобки показывают, что речь идет о составе, а не последовательности аминокислот в пептиде.
|
|