Переработка жидкого топлива
Крекинг нефтепродуктов может быть термическим и каталитическим. Термический крекинг проводится при температурах от 420 до 550°С и давлениях до 5 МПа. В настоящее время термический крекинг используется для получения ограниченного числа продуктов: котельного топлива из гудрона (висбрекинг), высокоароматизированного сырья, сырья для технического углерода (сажи), α-олефинов для производства моющих веществ. Для получения светлых нефтепродуктов, в том числе бензина, используется преимущественно метод каталитического крекинга. Это объясняется тем, что каталитические процессы нефтепереработки по сравнению с термическими имеют ряд преимуществ. К ним относятся:
—высокая скорость превращений углеводородов и, как следствие, более мягкие условия процесса и меньшие энергозатраты;
—увеличенный выход товарных продуктов, в том числе высокого качества (октановое число, стабильность);
—возможность проведения процесса в заданном направлении и получение продуктов определенного состава;
—использование сырья с высоким содержанием серы вследствие гидрирования сернистых соединений и выведения их в газовую фазу.
1.6.2 Термохимические превращения углеводородов
При высоких температурах углеводороды нефтяного сырья подвергаются разнообразным превращениям. Это первичные реакции деструкции, приводящие к образованию продуктов с меньшей молекулярной массой, и вторичные реакции изомеризации и конденсации, в результате которых образуются продукты с той же или большей молекулярной массой.
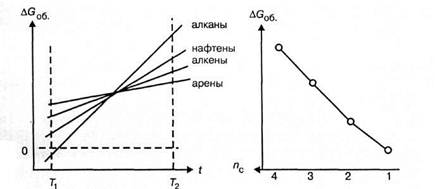
Тип этих реакций и, следовательно, скорость, глубина и последовательность превращений зависят от стабильности углеводородов различных классов в условиях крекинга. Мерой стабильности с достаточной степенью точности может служить величина изобарно-изотермического потенциала образования углеводородов AG°o6, который является сильной функцией температуры. В табл. 1.2 приведены значения AG°об углеводородов различных классов с одинаковым числом атомов углерода и углеводородов одного класса (алканов) с различным числом атомов углерода.
Из табл. 1.2 можно сделать следующие выводы:
1 При низкой температуре (291°К) углеводороды различных классов, но с одинаковым числом углеродных атомов в молекуле, по уменьшению их стабильности располагаются в ряд (ряд термической устойчивости)
CnH2n+2>∆CnH2n>CnH2n>CnH2n-6 .
Таблица 1.2 - Значения ∆G°об , кДж/моль углерода
|
Углеводород |
Формула |
Температура,°К | ||
| 291 |
100 |
1200 | ||
|
Гексан Циклогексан Гексен-1 Бензол |
С6Н14 С6Н12 С6Н12 С6Н6 | -0,29 31,1 17,6 129,9 |
317,9 221,2 |
554,9 300,5 |
|
Метан Этан Пропан Бутан |
СН4 С2Н6 С3Н1 С4Н10 | -50,1 -32,9 -23,5 -17,1 |
-2,3 66,6 127,4 115,0 |
41,0 151,6 255,4 355,1 |
2 Термодинамическая устойчивость углеводородов всех классов понижается с ростом температуры, но в различной степени, поэтому при высокой температуре (температуре крекинга) положение углеводородов в ряду термической устойчивости меняется (рис. 1.5):
CnH2n-6>CnH2n>∆CnH2n>CnH2n+2 .
3 Термическая устойчивость углеводородов одного класса падает с увеличением их молекулярной массы (числа атомов углерода) (рис. 1.6).
Таким образом, при температуре крекинга в первую очередь деструкции подвергаются алканы и нафтены преимущественно с высокой молекулярной массой, а наиболее устойчивыми являются ароматические углеводороды и алкены. В результате в продуктах крекинга накапливаются ароматические углеводороды и низшие алкены, которые затем вступают во вторичные реакции полимеризации.
Реакции превращения углеводородов нефтяного сырья при крекинге могут быть сведены к следующим типам.
|
|
|
углеводородов различных
классов от температуры
1 Термическая деструкция алканов по схеме
CnH2n+2→CmH2m+2+CpH2p
CqH2q+2+CxH2x ,
где: п = т + р; т = q + х .
При этом, в соответствии с рядом термической устойчивости, из продуктов реакции деструктируются далее в первую очередь алканы. Для низших алканов помимо реакции деструкции по связи С-С, энергия которой равна 315—370 кДж/моль, становится возможной и реакция дегидрирования с разрывом связи С-Н, энергия которой составляет 310—410кДж/моль и становится соизмеримой с первой. Поэтому в газе крекинга всегда содержится водород.
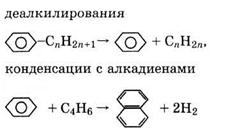
2 Превращения нафтенов, в том числе реакции:
дегидрирования
![]() ,
,
деалкилирования
![]() ,
,
гидрирования с разрывом цикла
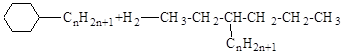 .
.
3 Превращения алкенов, в том числе реакции: деструкции с образованием низших алкенов, алканов и алкадиенов
CnH2n→2Cn/2Hn и CnH2n→CmH2m+2+CpH2p-2,
изомеризации R-CH=CH-CH3 → R-C=CH2,
![]() СН3
СН3
полимеризации CnH2n→C2nH4n .
4. Синтез и превращения ароматических углеводородов по реакциям конденсации алкенов и алкадиенов, например
![]() ,
,
|