Получение уксусной кислоты
Ацетальдегид (этаналь, уксусный альдегид) СНзСНО представляет собой бесцветную легкокипящую жидкость с резким удушливым запахом, с температурой кипения 20,2°С, температурой замерзания -123,5 °С и плотностью 783 кг/м3. Критическая температура ацетальдегида 188 °С, температура самовоспламенения 156°С. С воздухом ацетальдегид образует взрывчатые смеси с пределами воспламеняемости при 400°С 3,97 и 57,0% об. Смеси с кислородом воспламеняются при более низкой температуре - около 140 °С. Токсичен, пары ацетальдегида вызывают раздражении слизистых оболочек удушье, головную боль, ПДК составляет 5 мг/м3. Относится к 3-му классу опасности.
Ацетальдегид смешивается во всех отношениях с водой, этанолом, диэтиловым эфиром и другими органическими растворителями, с некоторыми образует азеотропные смеси.[1, с. 299 ].
Ацетальдегид - это один из важнейших многотоннажных продуктов переработки ацетилена и этилена. Он применяется в широких масштабах в промышленности органического синтеза. Важнейшие направления использования ацетальдегида:
o окисление в уксусную кислоту и уксусный ангидрид;
o получение циангидрина с последующей переработкой его в акрилонитрил, эфиры акриловой кислоты, молочную кислоту;
o альдольная конденсация и переработка альдоля в бутандиол-1,3 и бутадиен-1,3, н-бутанол, кротоновый альдегид;
o конденсация с аммиаком с образованием гомологов пиридина и винилпиридинов;
o конденсация с формальдегидом до пентаэритрита.
В настоящее время на производство уксусной кислоты и ее ангидрида, этилацетата и 2-этилгексанола расходуется в мире 95%, а в нашей стране 75% всего производимого ацетальдегида. [1, с. 300]
Помимо этого ацетальдегид или его триммер паральдегид применяют в производстве ацетатов целлюлозы, пероксиуксусной кислоты, этилацетата, глиоксаля, 2-этилгексанола, алкиламинов, алкилпиридинов, хлораля; как восстановитель применяется в производстве зеркал.[2, с.224]
1.2 Методы получения ацетальдегида
Известен ряд методов получения ацетальдегида. Рассмотрим эти методы.
1.2.1 Получение ацетальдегида гидратацией ацетилена на ртутных катализаторах
Реакция гидратации ацетилена на ртутных катализаторах была открыта М.Г. Кучеровым в 1881 г. и использовалась в промышленности с целью получения ацетальдегида более 60 лет:
![]()
Реакция сильно экзотермична. До 300 °С она практически необратима, но с дальнейшим ростом температуры равновесие смещается в сторону разложения ацетальдегида. Она протекает в нужном направлении с приемлемой скоростью в присутствии катализаторного раствора (10-20%-ная H2SO4, содержащая 0,5-0,6% HgO в виде HgSO4). Реакция протекает через промежуточное образование комплекса ацетилена с Hg2+. Дальнейшее его разложение приводит к образованию ацетальдегида[3, с.440]:
Скорость реакции увеличивается с повышением концентрации H2SO4 и температуры процесса, однако при этом возрастает и выход побочных продуктов, прежде всего за счет кротоновой конденсации с образованием кротонового альдегида: и альдольной конденсации с образованием смол (в том числе и с последующей полимеризацией кротонового альдегида).
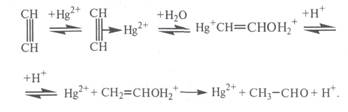
![]()
С целью сокращения образования побочных продуктов в реакционную зону подается избыток ацетилена, с которым получающийся ацетальдегид уносится из зоны реакции. Это приводит и к увеличению производительности установки. Вместе с тем подача в избытке ацетилена приводит к уменьшению выхода ацетальдегида за один проход через катализаторный раствор и увеличению рециркуляционных потоков. Конверсия ацетилена в ацетальдегид за один проход составляет 30-50 %.
Ацетальдегид является сильным восстановителем. В данном случае в его присутствии Hg2+ вначале восстанавливается до Hg+, а затем до металлической ртути:
![]()
в результате образуется ртутный шлам. Восстановителями также могут выступать H2S, РН3 и др. Этот процесс является крайне нежелательным, поскольку металлическая ртуть имеет высокое давление насыщенных паров, которые уносятся с реакционными газами, дезактивируя катализатор и загрязняя окружающую среду. Для предотвращения восстановления ртути в катализаторный раствор добавляют соли трехвалентного железа (в избытке по сравнению с солями ртути). Этим обеспечивается протекание реакции
Fe3+ + Hg+ ![]() Fe2+ + Hg2+
Fe2+ + Hg2+
поддерживающей ртуть в максимальной степени окисления.
Соль железа добавляют в избытке по отношению к ртути (~4%: в расчете на Fe2O3), поэтому катализаторный раствор работает достаточно длительное время. Однако в нем постепенно накапливаются соли двухвалентного железа, и раствор направляют на регенерацию, состоящую в окислении азотной кислотой. Несмотря на все эти мероприятия, ртуть все же теряется в виде шлама вместе с продуктами осмоления. Ее расход составляет 1-1,5 кг на 1 т ацетальдегида.[4, с. 195]
В промышленности процесс проводят при температуре 75-100 °С, пропуская ацетилен через водный катализаторный раствор. При 50 % конверсии ацетилена выход альдегида составляет 92-93% от прореагировавшего ацетилена. Основную реакцию осуществляют в полой футерованной колонне, заполненной катализаторным раствором и имеющей расширение в верхней части (заполненной насадкой).[3, с. 442]
Большим недостатком процесса синтеза ацетальдегида по Кучерову является необходимость применения дорогостоящей и весьма токсичной металлической ртути и ее соединений. Металлическая ртуть летуча; несмотря на высокую температуру кипения (357°С), она испаряется уже при комнатной температуре. При повышенной температуре в условиях процесса гидратации ртуть проникает почти во все аппараты установки и в получаемые продукты. Следствием этого являются значительные потери ртути и возможность профессиональных заболеваний у обслуживающего персонала.[5, с. 489]
Вместе с тем этот способ обладает многими преимуществами, которые могут быть успешно реализованы в других технологиях. В частности, этот процесс является одностадийным, обладает хорошей селективностью, может обеспечить одновременное получение двух целевых продуктов (ацетальдегид и кротоновый альдегид). Кроме того, реактор обеспечивает не только проведение собственно реакции, но и отделение продуктов от катализаторного раствора. Эффективное применение рециркуляции как по воде, так и ацетилену обеспечивает не только полное использование сырья, но и служит для подавления побочных реакций, повышая выход целевого продукта. Все это делает процесс достаточно привлекательным, однако высокотоксичная каталитическая система делает его бесперспективным.[3, с. 446]
1.2.2 Получение ацетальдегида гидратацией ацетилена в паровой фазе
Для этого процесса в качестве катализатора предлагались различные оксиды металлов и соли, в том числе фосфаты, вольфраматы, ванадаты, молибдаты, хроматы. Наибольшую активность и стабильность показал кадмийкальцийфосфатный катализатор, разработанный Ю.А.Гориным и С. М. Момозоном, состава CdHPO4•Ca3(PO4)2, обладающий кислотными свойствами. Этот катализатор активен при 350-400 °С, регенерируется воздухом и водяным паром при 400-450°С [3, с. 446], не токсичен, однако быстро теряет активность и требует регенерации через каждые 100 часов работы.
