Получение уксусной кислоты
Гидратация ацетилена в паровой фазе представляет гетерогенно-каталитическую экзотермическую реакцию, протекающую по уравнению:
С2Н2 + Н2О = СНзСНО ΔН = –162,8 кДж
Реакция гидратации протекает через образование промежуточного комплекса ацетилена с ионом кадмия, который затем разлагается с образованием ацетальдегида:
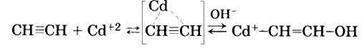
Одновременно с основной реакцией гидратации протекают побочные реакции дезактивации катализатора за счет его восстановления:
![]()
кротоновой конденсации:
![]()
и реакции последующего смолообразования.
При парофазной гидратации удаление ацетальдегида по мере его образования невозможно, а накопление его в реакционной зоне увеличивает вероятность побочных реакций, особенно кротоновой конденсации. Для подавления побочных реакций необходимо устранение местных перегревов, при которых развивается реакция кротоновой конденсации, имеющая более высокую энергию активации, применение избытка водяного пара, способствующего выводу ацетальдегида из сферы реакции, и проведение процесса при невысокой степени конверсии ацетилена.
Поэтому, процесс парофазной гидратации ацетилена проводят при объемном отношении водяного пара к ацетилену (7- 10): 1 и степени конверсии не выше 0,5. Образующийся ацетальдегид сорбируется из реакционной смеси водой. В этих условиях выход ацетальдегида чистотой до 99,5% мас. достигает 90%. В качестве побочных продуктов образуется 0,5-1,0% кротонового альдегида, 0,5-1,0% уксусной кислоты и 0,3% ацетона.[1, с. 302]
Активность катализатора снижается вследствие образования смолистых продуктов и зауглероживания. Поэтому к концу цикла (через 70-100 час) температуру увеличивают до 400-410°С, после чего катализатор подвергают регенерации.
Непрореагировавший ацетилен возвращается на синтез, 15- 20% ацетилена отводят для очистки от инертных газов. Продукты, выходящие из реактора, конденсируют, отгоняют от воды и подвергают ректификации. В итоге получается 99,5%-ный ацетальдегид и 85%-ный кротоновый альдегид в виде азеотропа с водой.
Вместе с тем этот процесс не нашел широкого распространения из-за небольшого срока службы катализатора без регенерации, его низкой механической прочности, токсичности (из-за наличия кадмия). С точки зрения принципов создания безотходных производств в нем плохо используется тепло реакции.[3, с. 446]
1.2.3 Получение ацетальдегида из ацетилена через бутилвиниловый эфир
Производство ацетальдегида из ацетилена этим методомпредставляет двухстадийный процесс винилирования н-бутанола ацетиленом с образованием винилбутилового эфира (ВБЭ):
С2Н2 + С4Н9ОН ![]() СН2=СН–О–С4Н9
СН2=СН–О–С4Н9
и последующего гидролиза ВБЭ:
СН2=СН–О–С4Н9 + Н2О ![]() СН3СНО + С4Н9ОН
СН3СНО + С4Н9ОН
Таким образом, в этом процессе бутанол находится в рецикле и добавляется только для пополнения производственных потерь, а на получение ацетальдегида расходуется только ацетилен.
Реакция винилирования протекает в присутствии гидроксида калия при температуре 400-440°С. Конверсия ацетилена составляет 0,6-0,8 при расходном коэффициенте по ацетилену 0,39-0,5 т/т ВБЭ. Реакционная смесь, содержащая 75- 80% ВБЭ, около 20% непрореагировавшего бутанола, воду и легкую фракцию, перед гидролизом разделяется методами ректификации или экстракции. На гидролиз направляется фракция, содержащая 99,5% винилбутилового эфира.
Реакция гидролиза ВБЭ протекает в парожидкостной среде при температуре, близкой к температуре кипения смеси «ВБЭ-вода», в присутствии катионнообменного катализатора КУ-2ФПП, который обеспечивает степень конверсии ВБЭ, близкую к единице. В результате гидролиза образуется система «ацетальдегид-вода-бутанол», из которой ректификацией выделяется целевой продукт - ацетальдегид, а бутанол возвращается в процесс.[1, с.304]
1.2.4 Получение ацетальдегида окислительным дегидрированием этилового спирта
При окислительном дегидрировании этилового спирта протекают последовательно две реакции:
CH3 – CH2–OH ![]() CH3–CHO + H2 ΔН=15 ккал
CH3–CHO + H2 ΔН=15 ккал
H2 + 0,5O2 ![]() H2O ΔН= –58 ккал
H2O ΔН= –58 ккал
Для уменьшения теплового эффекта процесса вводят меньше воздуха. Например, спирт можно смешивать с воздухом в отношении 1 : 1,1, что соответствует расходу кислорода 44% от теоретического. При пропускании такой смеси над серебряным катализатором при 450-550°С очень интенсивно протекает дегидрирование этилового спирта и выходящий из контактного аппарата газ содержит 10% водорода.[5, с.491]
1.2.5 Получение ацетальдегида дегидрированием этилового спирта
При каталитическом дегидрировании этилового спирта образуется уксусный альдегид:
CH3 – CH2–OH ![]() CH3–CHO + H2
CH3–CHO + H2
При получении ацетальдегида этим методом применяют медные или медно-цинковые катализаторы. Медь для данного процесса является высокоактивным катализатором, но она быстро теряет активность. Хорошим стойким катализатором является медь с добавками 5% оксида кобальта и 2% оксида хрома, нанесенная на асбест. В присутствии этого катализатора процесс можно проводить при сравнительно низких температурах (275-300° С). Степень превращения спирта в этих условиях составляет 33-50% за один проход через катализатор.
Достоинством процесса дегидрирования спирта по сравнению с процессом окислительного дегидрирования является относительно малое образование побочных продуктов и высокое содержание ацетальдегида в контактных газах. Контактные газы процесса дегидрирования в основном состоят из паров ацетальдегида и водорода (примерно 1 : 1), в то время как контактные газы окисления спирта разбавлены азотом, вводимым с воздухом. Поэтому выделение ацетальдегида из контактных газов дегидрирования спирта легче и сопряжено с меньшими потерями альдегида. Кроме того, при дегидрировании этилового спирта образуется ценный побочный продукт– этилацетат (9-10% от количества ацетальдегида).[5, с. 492]
1.2.6 Получение ацетальдегида окислением этилена
Образование ацетальдегида при взаимодействии этилена с водным раствором хлористого палладия наблюдал Филлипс ещё в 1894 г. Образующийся в безводной среде комплекс этилена с хлористым палладием был описан Карашем в 1938 г. При взаимодействии палладиевого комплекса с водой происходит окисление активированного олефина с образованием ацетальдегида, выделением палладия и хлорида водорода. [6, с.302]
Непрерывный процесс получения ацетальдегида, в котором восстановление до металлического Pd совмещается с непрерывным его окислением кислородом воздуха, был предложен в 1959 г. Я. К. Сыркиным, И.И. Моисеевыми, М.Н. Варгафтиком. Этот процесс может протекать в одну стадию (в одном аппарате происходит как окисление этилена, так и выделяющегося палладия) или в две стадии: окисление (карбонилирование) олефина через стадию образования активного комплекса и восстановление Pd протекает в одном аппарате, а окисление металлического Pd - в другом:
