Получение уксусной кислоты
Наиболее легко реагирует йодистый водород. Фтористый водород часто (особенно в присутствии влаги) присоединяется с одновременной полимеризацией олефина. С хорошими выходами алкилфториды получаются при действии на алкены растворов HF в третичных аминах (триэтиламин, пиридин) и тетрагидрофуране при О°С. Присоединение хлористого водорода требует обычно нагревания или присутствия катализаторов.
Механизм электрофильного присоединения галогеноводородов двухступенчатый, как и механизм присоединения галогенов, однако π-комплексы в этом случае, вероятно, не образуются: реакции идут через карбениевые ионы и, следовательно, должны быть нестереоспецифичными. Наблюдаемая в ряде случаев стереоспецифичность объясняется тем, что в реакции участвуют не свободные карбениевые ионы, а ионные пары карбениевый ион - анион.[16, с. 81]
4. Гипогалогенирование. Присоединение к олефинам гипогалогенитных кислот и их эфиров осуществляется согласно следующей реакции:
CH2 = СН2 + НОС1 ![]() СН2Сl-СН2ОН.
СН2Сl-СН2ОН.
5. Гидратация. В присутствии катализаторов олефины присоединяют воду, образуя спирты [16, с. 83]:
СН2=СН2 + НОН ![]() CH3-CH2OH
CH3-CH2OH
6. Окисление. Олефины окисляются кислородом воздуха или другими окислителями. Направление окисления зависит от условий реакции и выбора окислителя.
а) Кислородом воздуха в присутствии серебряного катализатора олефины окисляются до органических оксидов:
2СН2=СН2 + О2 ![]() CH2–CH2
CH2–CH2
О
б) Разбавленный раствор перманганата калия (реакция Вагнера) или пероксид водорода в присутствии катализаторов (CrO3, OsO4 и др.) с олефинами образуют гликоли. По месту двойной связи присоединяются два гидроксила:
3СН2=СН2 + 2KMnO4 + H2O![]() 3CH2OH–CH2OH +2MnO2 +2KOH
3CH2OH–CH2OH +2MnO2 +2KOH
СН2=СН2 + H2O2![]() CH2OH–CH2OH
CH2OH–CH2OH
в) При действии концентрированных растворов окислителей (перманганат калия, хромовая кислота, азотная кислота) молекула этилена разрывается по месту двойной связи, образуя муравьиную кислоту:
CH2 = СН2 ![]() 2СНООН.
2СНООН.
д) Прои реакции озонолиза, озон присоединяется по месту двойной связи, образуя нестойкое соединение, озонид, при обработке водой из него образуется пероксид водорода и муравьиный альдегид:
CH2 = СН2 + О3![]()
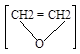
![]()
![]()
![]() 2CH2O +H2O2
2CH2O +H2O2
7. Полимеризация. Одним из наиболее важных для современной техники превращений олефинов является реакция полимеризации. Полимеризация олефинов может быть вызвана нагреванием, сверхвысоким давлением, облучением, действием свободных радикалов или катализаторов [16, с. 87].
n CH2=CH2![]() [-CH2-CH2 -]n
[-CH2-CH2 -]n
1.3.3.2 Химические свойства ацетальдегида
1. Гидрирование. Присоединение водорода к происходит в присутствии катализаторов гидрирования (Ni, Со, Си, Pt, Pd и др.). При этом он переходит в этиловый спирт:
CH3CHO + H2![]() C2H5OH
C2H5OH
При восстановлении альдегидов или кетонов водородом в момент выделения (с помощью щелочных металлов или амальгамированного магния) образуются наряду с соответствующими спиртами в незначительных количествах образуются также гликоли:
2 CH3CHO + 2Н![]() CH3 – CH – CH – CH3
CH3 – CH – CH – CH3
ОН ОН
2. Реакции нуклеофильного присоединения
2.1 Присоединение магнийгалогеналкилов [16, с.168]
СН3 – СН2 – MgBr + CH3CHO![]() BrMg – O – CH – C2H5
BrMg – O – CH – C2H5
CH3
2.2 Присоединение синильной кислоты приводит к образованию нитрила α-гидроксипропионовой кислоты:
OH
CH3CHO + HCN ![]() CH3 – CH – CN
CH3 – CH – CN
2.3 Присоединение гидросульфита натрия дает кристаллические вещество – производное ацетальдегида:
OH
CH3CHO + HSO3Na![]() CH3 – C – SO3Na
CH3 – C – SO3Na
H
2.4 Взаимодействие с аммиаком приводит к образованию ацетальдимина [16, 169] :
CH3CHO + NH3![]() CH3–CH=NH
CH3–CH=NH
2.5 С гидроксиламином ацетальдегид, выделяя воду, образует ацетальдоксимоксим:
CH3CHO + H2NOH ![]() H2O + CH3–CH =NOH
H2O + CH3–CH =NOH
2.6 Особый интерес представляют реакции ацетальдегида с гидразином и его замещенными [16, с. 171]:
CH3CHO + H2N – NH2 + OCHCH3 ![]() CH3–CH=N–N=CH–CH3 + 2H2O
CH3–CH=N–N=CH–CH3 + 2H2O
Альдазин
2.7 Ацетальдегид способен присоединять по карбонильной группе воду с образованием гидрата - геминального гликоля. При 20˚С ацетальдегид в водном растворе на 58% существует в виде гидрата
–C– + HOH ![]() HO–C–OH
HO–C–OH
O
2.8 При действии на ацетальдегид спиртов образуются полуацетали:
OH
CH3CHO + HOR ![]() CH3–CH
CH3–CH
OR
В присутствии следов минеральной кислоты образуются ацетали[16, с. 172]
OH OR
CH3 – CH + ROH ![]() CH3 – CH + H2O
CH3 – CH + H2O
OR OR
2.9 Ацетальдегид при взаимодействии с РС15 обменивает атом кислорода на два атома хлора, что используется для получения геминального дихлорэтана:
CH3CHO + РС15![]() CH3CHСl2 + POCl3
CH3CHСl2 + POCl3
3. Реакции окисления
Ацетальдегид окисляются кислородом воздуха до уксусной кислоты. Промежуточным продуктом являются надуксусная кислота:
CH3CHO + O2![]() CH3CO-OOH
CH3CO-OOH
CH3CO-OOH + CH3CHO![]() CH3-C-O-O-CH-CH3
CH3-C-O-O-CH-CH3![]()
O OH
2CH3COOH
Аммиачный раствор гидроксида серебра при легком нагревании с альдегидами окисляет их в кислоты с образованием свободного металлического серебра. Если пробирка, в которой идет реакция, была предварительно обезжирена изнутри, то серебро ложится тонким слоем на ее внутренней поверхности - образуется серебряное зеркало [16, 173]:
CH3 CHO + 2[Ag(NH3)2]OH![]() CH3COONH4 + 3NH3 + H2O + 2Ag
CH3COONH4 + 3NH3 + H2O + 2Ag
4. Реакции полимеризации
