Получение уксусной кислоты
2.2 Расчёт термодинамических функций
Установим зависимость изменения теплоёмкости от температуры Δср= f(T):
Δср=Δa + ΔbT + Δc'T-2 + ΔcT2
Δa=Σ(υa)j – Σ(υa)i = –14,05
Δb= Σ(υb)j – Σ(υb)i = 29,79•10-3
Δc'= Σ(υc')j – Σ(υc')i = 1,88•105
Δc= Σ(υc)j – Σ(υc)i = –15,8•10-6
Стандартные значения изменений термодинамических величин:
ΔН°298 = Σ(υ ΔН°f, 298)j – Σ(υ ΔН°f, 298)i = –218,3 кДж/моль
ΔН°298<0, следовательно реакция экзотермична
ΔS°298 = Σ(υ S°298)j – Σ(S°298)i = –57,77 Дж/моль•К
Согласно уравнению Гиббса-Гельмгольца
ΔG°298 = ΔН°298 – T• ΔS°298 = –201,08 кДж/моль
ΔG°298 <0, следовательно при стандартных условиях реакция может протекать в прямом направлении.
Определим зависимость ΔН°T= f(T), подставив Δср= f(T) в уравнение Кирхгофа:
ΔН°T= ΔН°298 + Δc°pdt = ΔН°298 + Δa(T – 298) + Δb(T2 – 2982)/2 – Δc'(T-1 – 298-1)+ Δc(T3 – 2983)
Подставив в полученную зависимость значения температур в интервале 25 – 175°С, найдём характер изменения зависимости ΔН°f= f(T):
| Т, К | 313 | 328 | 343 | 358 | 363 | 378 | 393 | 408 | 433 | 448 |
| –ΔН° Т , кДж/моль | 218,37 | 218,43 | 218,49 | 218,55 | 218,57 | 218,63 | 218,68 | 218,74 | 218,82 | 218,86 |
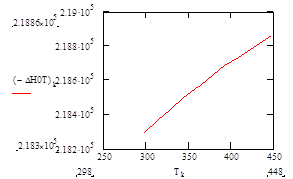
Рис.5 Зависимость теплового эффекта реакции –ΔН°от температуры.
Определим зависимость ΔS°= f(T)
ΔS°T= ΔS°298 + Δc°pdt/T = ΔS°298 + Δa(lnT – ln298) + Δb(T – 298) –
–Δc'/2(T-2 – 298-2)+ + Δc/2(T2 – 2982)
| Т, К | 313 | 328 | 343 | 358 | 363 | 378 | 393 | 408 | 433 | 448 |
| –ΔS° Т , Дж/моль | 57,98 | 58,19 | 58,37 | 58,54 | 58,60 | 58,75 | 58,89 | 59,03 | 59,22 | 59,32 |
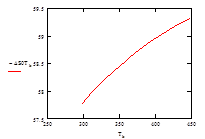
Рис.6 Зависимость изменения энтропии ΔS° от температуры
Пользуясь уравнением Гиббса-Гельмгольца:
ΔG°T = ΔН°T – T • ΔS°T,
рассчитаем значения ΔG° при соответствующих температурах:
| Т, К | 313 | 328 | 343 | 358 | 363 | 378 | 393 | 408 | 433 | 448 |
| –ΔG° Т , кДж/моль | 200,22 | 199,35 | 198,47 | 197,59 | 197,30 | 196,42 | 195,54 | 194,65 | 193,18 | 192,29 |
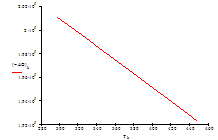
Рис.7 Зависимость изменения энергии Гиббса ΔG от температуры
Пользуясь уравнением изотермы Вант-Гоффа:
ΔG = – RT•lnkp,
вычислим значения констант равновесия:
lnkp = – ΔG /(RT)
|
Т, К |
313 |
328 |
343 |
358 |
363 |
378 |
393 |
408 |
433 |
448 |
|
lnkp |
76,9388 |
73,1007 |
69,5973 |
66,3866 |
65,7352 |
62,5208 |
59,8453 |
57,3843 |
53,6606 |
51,6252 |
|
kp |
2,59•1033 |
5,59•1031 |
1,68•1030 |
6,78•1028 |
2,47•1028 |
1,39•1027 |
9,78•1025 |
8,35•1024 |
2,02•1023 |
2,63•1022 |
