Расчет термодинамических параметров различных веществ
1) Т = 298…383
ΔНт = 1059837,912 – 161,43*Т – 0,5*0,2836Т2 +545000/T
2) T = 383…432
ΔHт = ΔН383 – 125,36*Т – 0,5*0,01984*Т2 + 413000/Т + ΔНп.п.(Н2О)
3)Т = 432…800
ΔHт = ΔН432 – 116,84*Т – 0,5*0,0228*Т2 + 2053000/Т + ΔНп.п.(PCl5)
Расчет теплового эффекта реакции при температурах 300, 388, 432, 500,700, 800 К:
![]() =1059837,912 +161,43·300 – 0,5·0,2836*3002 +
=1059837,912 +161,43·300 – 0,5·0,2836*3002 +![]() =1000465,38 Дж/моль
=1000465,38 Дж/моль
![]() =1059837,912 +161,43*383 – 0,5·0,2836·3832 +
=1059837,912 +161,43*383 – 0,5·0,2836·3832 +![]() + 8912=999601,48 Дж/моль
+ 8912=999601,48 Дж/моль
![]() =999601,48 -125,36*432 – 0,5·0,01984·4322 +
=999601,48 -125,36*432 – 0,5·0,01984·4322 + ![]() + 12657,6=957212,59 Дж/моль
+ 12657,6=957212,59 Дж/моль
![]() =957212,59 -116,84*500 – 0,5·0,0228*5002 +
=957212,59 -116,84*500 – 0,5·0,0228*5002 + ![]() =900052,34 Дж/моль
=900052,34 Дж/моль
![]() =957212,59 -116,84*700 – 0,5·0,0228*7002 +
=957212,59 -116,84*700 – 0,5·0,0228*7002 + ![]() =872778,80 Дж/моль
=872778,80 Дж/моль
![]() =957212,59 -116,84*800 – 0,5·0,0228*8002 +
=957212,59 -116,84*800 – 0,5·0,0228*8002 + ![]() =859020,44 Дж/моль
=859020,44 Дж/моль
Расчет изменения теплоёмкости при температурах 300,388,432, 500, 700, 800 К:
∆Ср = ![]() = -161,43 – 0,2836·Т +
= -161,43 – 0,2836·Т + ![]()
∆Ср300 = -161,43 – 0,2836·300 + ![]() = - 240,44 Дж/моль·К
= - 240,44 Дж/моль·К
∆Ср383 = -161,43 – 0,2836·383 + ![]() = - 252,50 Дж/моль·К
= - 252,50 Дж/моль·К
∆Ср432 = -125,36 – 0,01984*432 + ![]() = - 131,71 Дж/моль·К
= - 131,71 Дж/моль·К
∆Ср500 = -116,84 – 0,0228*500 + ![]() = - 120,01Дж/моль·К
= - 120,01Дж/моль·К
∆Ср700 = - 116,84 – 0,0228·700 + ![]() = - 128,59 Дж/моль·К
= - 128,59 Дж/моль·К
∆Ср800 = - 116,84 – 0,0228·800 + ![]() = - 131,85 Дж/моль·К
= - 131,85 Дж/моль·К
2. Постройте графики зависимости ∆Сp = f(Т), ∆HТ = f(Т). При расчете ∆HТ учитывайте фазовые и полиморфные превращения всех участников реакции в данном температурном интервале.
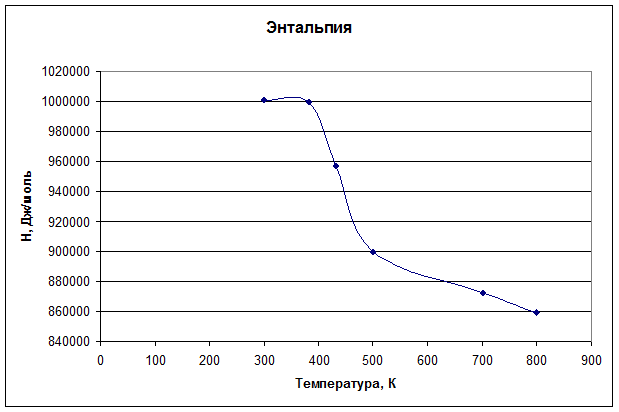
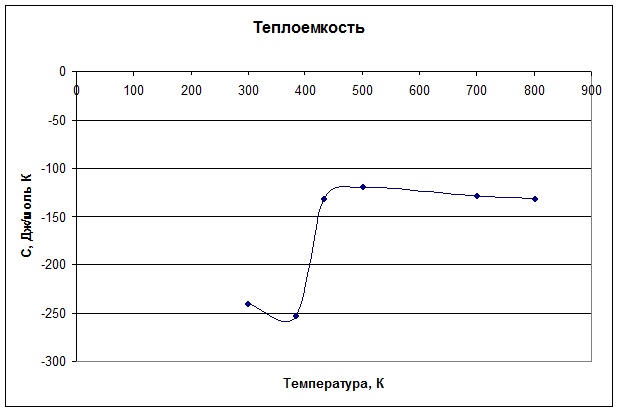
| |
3. Рассчитайте изменение энтропии реакции. Постройте график зависимости изменения энтропии от температуры с шагом 200 К в интервале 300–800 К.
Расчет изменения энтропии реакции.
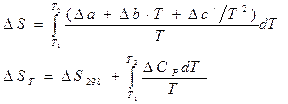
∆S 298 = ![]() +
+ ![]() –
– ![]() – 4
– 4![]()
![]() =200,83+ 5*186,79– 170,8 – 4*69,95= 684,18 Дж/моль·К
=200,83+ 5*186,79– 170,8 – 4*69,95= 684,18 Дж/моль·К
![]()
![]() = 684,18 + 161,43·ln(300/298) – 0,2836·(300–298) + 0,5·545000
= 684,18 + 161,43·ln(300/298) – 0,2836·(300–298) + 0,5·545000![]() = 682,57 Дж/моль·К
= 682,57 Дж/моль·К
![]() = 684,18 + 161,43·ln(383/298) – 0,2836·(383–298) + 0,5·545000
= 684,18 + 161,43·ln(383/298) – 0,2836·(383–298) + 0,5·545000![]() + 8912/383 = 705,92 Дж/моль·К
+ 8912/383 = 705,92 Дж/моль·К
![]() = 705,92 - 125,36·ln(432/383) – 0,01984·(432–383) + 0,5·413000
= 705,92 - 125,36·ln(432/383) – 0,01984·(432–383) + 0,5·413000![]() +12657,6/432 = 703,30 Дж/моль·К
+12657,6/432 = 703,30 Дж/моль·К
![]() = 703,30 – 116,84·ln(500/432) – 0,0228·(500–432) + 0,5·2053000
= 703,30 – 116,84·ln(500/432) – 0,0228·(500–432) + 0,5·2053000![]() = 686,07 Дж/моль·К
= 686,07 Дж/моль·К
![]() = 703,30 – 116,84·ln(700/432) – 0,0228·(700–432) + 0,5·2053000
= 703,30 – 116,84·ln(700/432) – 0,0228·(700–432) + 0,5·2053000![]() = 644,21 Дж/моль·К
= 644,21 Дж/моль·К
![]() = 703,30 – 116,84·ln(800/432) – 0,0228·(800–432) + 0,5·2053000
= 703,30 – 116,84·ln(800/432) – 0,0228·(800–432) + 0,5·2053000![]() = 626,82 Дж/моль·К
= 626,82 Дж/моль·К
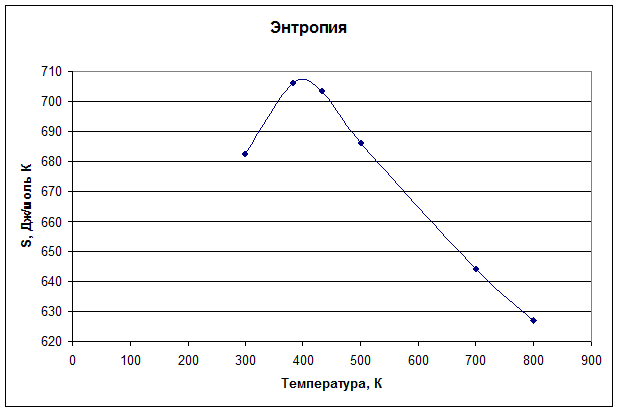
| |
| |
![]()
![]() = 1000465,38– 300·682,52 = 795693,22 Дж/моль
= 1000465,38– 300·682,52 = 795693,22 Дж/моль
![]() = 999601,48– 383·705,92 = 760999,80 Дж/моль
= 999601,48– 383·705,92 = 760999,80 Дж/моль
![]() = 957212,59– 432·703,30 = 653387,05 Дж/моль
= 957212,59– 432·703,30 = 653387,05 Дж/моль
![]() = 900052,34 – 500·686,07 = 557019,39 Дж/моль
= 900052,34 – 500·686,07 = 557019,39 Дж/моль
![]() = 872778,80 – 700·644,21 = 421832,08 Дж/моль
= 872778,80 – 700·644,21 = 421832,08 Дж/моль
![]() = 859020,44 – 800·626,82 = 357563,02 Дж/моль
= 859020,44 – 800·626,82 = 357563,02 Дж/моль
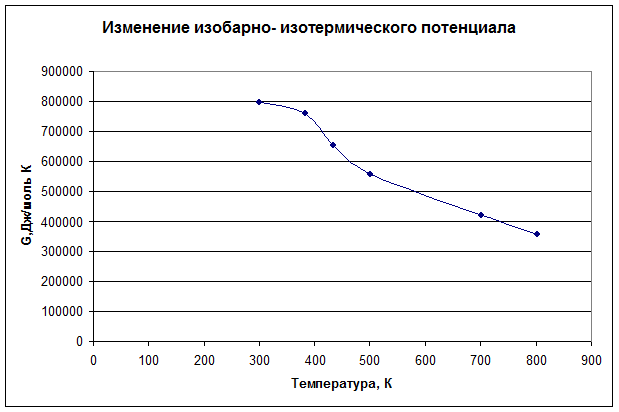
5. Сделайте вывод о направлении протекания данной реакции.
Так как ![]() > 0, при данных условиях реакция протекать не будет.
> 0, при данных условиях реакция протекать не будет.
