Расчет термодинамических параметров различных веществ
Задание №2.
Химическое равновесие.
I.Реакция протекает в газовой фазе с образованием продуктов реакции по схеме:
ν1А + ν2В = ν3D + ν4F
1. Выразите в общем виде константы равновесия КР и КС реакции B через равновесное количество молей вещества D, равное х, если исходные вещества взяты в стехиометрических количествах при общем давлении Р = 1,013*105 Па (1 атм.) и температуре Т= 500 К. Газообразные вещества, участвующие в химической реакции, находятся в идеальном состоянии.
2СО + 2Н 2 =СН3СООН(г)
2(1-х) 2(1–х) х Σ = 2–2х + 2–2х + х = 4 – 3х
![]()
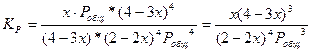
![]()
∆νi= 1- 2-2 = -3
![]() =
=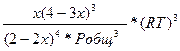
2. Каквлияет на равновесный выход продукта D увеличение общего давления системы.
Попринципу Ле–Шателье: если на систему, находящуюся в состоянии равновесия, оказывать внешнее воздействие, то в системе происходит такое смещение равновесия, которое ослабляет это воздействие.
При общем увеличении давления системы, равновесие сместится слева направо, т.к. из 4 молей исходных веществ образовался 1 моль продуктов реакции.
3. Рассчитайте константу равновесия реакции B при Т = 500 К и Р = 1,013·105 Па, х = 0,4.
![]()
4. Вычислите равновесный выход продукта D при P = 3,0·104 Па и Т= 500 К.
![]()
![]()
![]()
х=0,1549
5. Рассчитайте химическое сродство ΔG, кДж, для реакции. Парциальные исходные давления компонентов реакции приведены в таблице 2.
Таблица 2
| Парциальные давления, атм. | ||
|
|
|
|
| 0,1 | 0,1 | 0,2 |
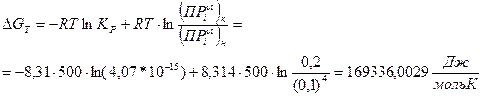
6. Сделайте вывод о направлении протекания реакции.
Так как ∆Gº500>0, то реакция при Т = 500 К самопроизвольно протекать не может.
II. Гетерогенная реакция протекает при постоянной температуре Т:
Таблица 3
| Реакция | T, К | Р1·10-2 ,Па | Р2·10-2,Па | Р3·10-2,Па | V·103,Па |
| 2С + О2 = 2СО | 773 | 10 | 705 | 800 | 9 |
1.Определить нормальное сродство веществ А и В при температуре Т=298 К.
Таблица 4
| Вещество |
|
| Коэффициенты ур-я | ||
| а | b | c′ | |||
| С | 0 | 5,74 | 16,86 | 0,00477 | -854000 |
| О2 | 0 | 205,04 | 31,46 | 0,00339 | -377000 |
| СО | –110530 | 197,55 | 28,41 | 0,0041 | 410000 |
ΔG=ΔH- TΔS
![]()
![]()
![]()
2. Вычислить константы равновесия Кр и Кс реакции.
∆а =2Δ асо+ 2Δ![]() – Δ
– Δ![]() = 2*28,41 – 2*16,86 –31,46 = –8,36
= 2*28,41 – 2*16,86 –31,46 = –8,36
∆в = 2*0,0041- 2*0,00477- 0,00339=-0,00473
∆с′ = 2*410000- 2*(-854000)+377000=2905000
![]()
![]() =
= ![]() +
+ ![]()
ΔН= -221060- 7,15= -221067,15 Дж/моль
![]()
![]()
![]() = 178,58- 7,15=171,43Дж/мольК
= 178,58- 7,15=171,43Дж/мольК
