Расчет термодинамических параметров различных веществ
HJO3=H+ JO![]()
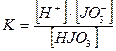
![]()
![]() - степень диссоциации.
- степень диссоциации.
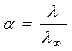 ,
, 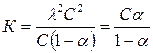 ,
,
![]() ;
;
![]() ;
;
![]() .
.
Т.к.К1≠К2≠К3 – не подчиняется закону Оствальда. Следовательно,HSO3– сильный электролит.
3. Вычислить по данным зависимости эквивалентной электропроводности от концентрации эквивалентную электропроводность при бесконечном разведении.
|
λ |
27,78 | 31,01 |
34 | 36 | 38 | 38 | 38 | 25,6 |
|
С |
0,1 |
0,05 |
0,02 |
0,01 |
0,005 |
0,003 |
0,001 |
0,1 |
Закон Кольрауша:
![]() .
.
λграф=38 Ом-1,
Следовательно λтеор![]() >
>![]() граф. ; 39,25>38
граф. ; 39,25>38
5. Если раствор является сильной кислотой или основанием, вычислить для него рН при с=0,1 кмоль/м3 с учетом ионной силы раствора.
С=0,1 моль/л
рН - ?
J - ?
![]() - ионная сила раствора.
- ионная сила раствора.
![]() .
.
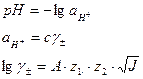
![]()
γ±=1,4507
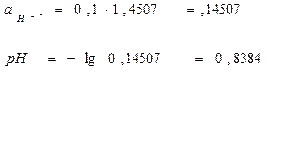
рН<7, следовательно, среда кислая.
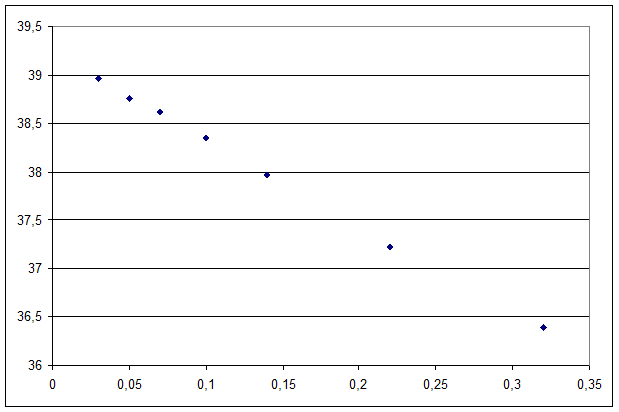
5. Для сильного электролита на основании зависимости эквивалентной электропроводности от ![]() , которая дается уравнением Кольрауша λ = λ
, которая дается уравнением Кольрауша λ = λ![]() - А
- А![]() , рассчитать эквивалентную электропроводность при бесконечном разведении и постоянную уравнения графически.
, рассчитать эквивалентную электропроводность при бесконечном разведении и постоянную уравнения графически.
|
| 0,32 | 0,22 | 0,14 | 0,1 | 0,07 | 0,05 | 0,03 |
| C | 0,1 | 0,05 | 0,02 | 0,01 | 0,005 | 0,003 | 0,001 |
Строим график зависимости λ = f(![]() )
)
| λ | 36,39 | 37,23 | 37,97 | 38,35 | 38,61 | 38,76 | 38,96 |
|
| 0,32 | 0,22 | 0,14 | 0,1 | 0,07 | 0,05 | 0,03 |
![]()
![]()
λ0= 50 Ом-1
x = 0,22-0,14 = 0,08
y = 37,97-37,23 = 0,74
tg α = К
tg α = y/x = 9,25
К = 9,25
ЗАДАНИЕ № 5
Кинетические закономерности протекания химических реакций
С12Н22О11+Н2О=С6Н12О6+С6Н12О6
| Время, мин | Контроль за ходом реакции, а=в-конц. исх. веществ, моль/л |
| 0 | 1 |
| 1435 | 1,081 |
| 4315 | 1,266 |
| 7070 | 1,464 |
| 11360 | 1,830 |
| 14170 | 2,117 |
| 16935 | 2,466 |
| 19815 | 2,857 |
| 29925 | 4,962 |
