Регенерация азотной и серной кислоты
2.8 Расчет материального баланса концентрирования H2SO4
Исходные данные:
1. Температура кислоты на входе 150 ОС
2. Температура кислоты на выходе 250 ОС
3. Температура дымовых газов на входе 900 ОС
4. Температура дымовых газов на выходе 130 ОС
1. Потери при концентрировании составляют 0,06%, из них 50% на разложение SO2 и 50% - теряется в виде паров серной кислоты
В вихревую колонну поступает разбавленная серная кислота (с учетом потерь):
Gразб = G(1-0,0006) = 7654,87*0,9994 = 7650,28 кг.
в том числе воды:
![]() = Gразб(1-
= Gразб(1-![]() ) = 7650,28(1-0,7) = 2295,08 кг.
) = 7650,28(1-0,7) = 2295,08 кг.
В колонну подается кислота ( в пересчете на моногидрат):
Gпр = G(1-0.0006)![]() = 7650,28*0,7 = 5355,2 кг.
= 7650,28*0,7 = 5355,2 кг.
2. При концентрировании серная кислота разлагается по формуле:
H2SO4 = SO2 + H2O + 1/2O2
Qразл = 228900 кДж/кмоль – теплота разложения H2SO4. Потери от разложения составляют 50% общих потерь или 0,03%:
Gпот = Gт*0,03/100 = 7650,28*0,0003 = 2,3 кг.
3. Потери вследствие уноса серной кислоты с дымовыми газами составляют также 50% общих потерь (0,03%)
Gун = 0,0003*7650,28 = 2,3 кг.
4. Общие потери составляют:
Gпот = Gун + Gразл = 2.3*2 = 4.6 кг.
5. При разложении серной кислоты образуется:
H2SO4 = SO2 + H2O + 1/2O2
![]() = 98;
= 98; ![]() = 64
= 64
SO2 = ![]() = 1,5 кг.
= 1,5 кг.
O2 = ![]() = 0,38 кг.
= 0,38 кг.
H2O = ![]() = 0,42 кг.
= 0,42 кг.
6. В колонне выпариваются воды:
Gвых = Gразл[(1-Gисх/100)-( 1-Gк/100)] = 7650.28[(1-70/100)-(1-91/100)] = 1606,56 кг.
7. Выход 91% продукционной H2SO4:
Gкон= Gразл- Gразл[(1-Gисх/100)-( 1-Gк/100)] ] = 7650.28-1606.56=6043.76 кг.
8. Приход кислоты по моногидрату:
Gпр = Gисх![]() = 7650,28*0,7 = 5355,2 кг.
= 7650,28*0,7 = 5355,2 кг.
2.9. Расчет теплового баланса вихревой колонны [4]
Приход тепла:
1. с разбавленной серной кислотой 70% при t = 150 ОС
Q1 = QпрHпр = 7654.87*342 = 2617934.76 кДж = 624805,43 ккал.
Hпр = 342 кДж/кг – энтальпия исходной кислоты
2. С дымовыми газами, поступившими из топки:
Q2 = ![]() = 31,37х*1,45*900 = 40937,85х кДж = 9770,37 ккал.
= 31,37х*1,45*900 = 40937,85х кДж = 9770,37 ккал.
V2 = 31,37 м3 – объем газов
С2 = 1,450 кДж/м3 град
Общий приход тепла: Qобщ = Q1+ Q2 = 2617934,76+40937,85х кДж
Расход тепла
1. С продукционной кислотой при 250 ОС:
Q1 = Ck*Hk = 5355.2*458 = 2452681.6 кДж = 585365,54 ккал
Hк = 458 кДж/кг – энтальпия серной кислоты 91%
2. С водяным паром выделяется при выпаривании и разложении:
Q2 = Cвп*Hвп = 1606.98*2737.7 = 4399429.15 кДж = 1049983.09 ккал
Gвп = Gуп + Gразл = 1606,56 + 0,42 = 1606,98 кг.
Hвп = 2737,7 кДж/кг – энтальпия водяного пара
Gуп и Gразл – из материального баланса.
3. С дымовыми газами, уходящими с t = 30 ОС:
Q3 = ![]() = 31,37х*1,336*130 = 5448,34х кДж = 1300,32 ккал.
= 31,37х*1,336*130 = 5448,34х кДж = 1300,32 ккал.
V2 – объем дымовых газов на м3 сжигаемого газа
С2 = удельная теплоемкость дымовых газов при t=130 ОС
С2 = 1,336 кДж/м3 град
4. На испарение серной кислоты:
Q4 = Gисп + Hисп=2,3*511,2=1175,76 кДж=280,61 ккал
Нисп=511.2 кДж/кг - удельная теплота парообразования серной кислоты
5. С парами серной кислоты:
Q5 = Gисп + H = 2,3*201,4=463,22 кДж=110,55 ккал
Н – энтальпия 100% серной кислоты при температуре отходящих газов 130 ОС.
6. На разложение серной кислоты:
Q6 = 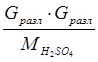 =
= ![]() =5372,14 кДж = 1282 ккал.
=5372,14 кДж = 1282 ккал.
7. С продуктами разложения серной кислоты в результате разложения серной кислоты при температуре отходящих газов 130 ОС образуются:
![]() =1,5 кг.; =0,38 кг.;
=1,5 кг.; =0,38 кг.; ![]() =2,3 кг
=2,3 кг
Q7 = (![]() *
*![]() +
+ ![]() *
*![]() )t=(0.963 + 0.353)130 = 171.08 кДж = 40,83 ккал
)t=(0.963 + 0.353)130 = 171.08 кДж = 40,83 ккал
8. При концентрировании серной кислоты (дегидратации) от 70% до 91% расходуется тепла:
Q8=Gуп(Q70%- Q91%)
Q70% = 427,4 кДж/кг – теплота разбавления до 70%
Q91% = 157,3 кДж/кг – теплота разбавления до 91%
Q8 = 5355,2(427,4-157,3)=1446439,52 кДж = 345212,3 ккал
9. Потери тепла в окружающую среду примем 1% от общего количества расхода тепла на концентрировании серной кислоты:
Q= 2452681,6 + 4399429,15 + 5448,34х + 463,22 + 1175,76 + 5372,14 + 171,08 + 1446439,52 = 5853050,87 + 5448,34 х кДж
Qд = 58530,51 + 54,48 х к`Дж
Qрасх = 5911581,38 + 5502,82 х кДж
10. Для определения расхода топлива ^приравниваеме приход тепла к расходу:
Qобщ = Qрасх
2617934,76+40937,85х=5911581,38+5502,88х
35435,03х=3293646,62
х=92.95
11. Определяем часовое количество и состав газов, поступающих на установку из топки.
Таблица №14 - Количество и состав газов из топки
|
газы |
м3 |
кг. |
|
CO2 : 1,27*92,95 |
118,5 |
231,87 |
|
N2: 24,43*92,95 |
2270,77 |
2838,46 |
|
O2: 4,03*92,95 |
374,59 |
535,13 |
|
H2O: 2,68*92,95 |
249,11 |
200,17 |
|
Всего |
3012,52 |
3805,63 |
12. Определяем часовое количество газов, уходящих с установки:
Таблица №15 - Часовое количество газов
|
газы |
м3 |
кг. |
|
CO2 : |
118.05 |
231.87 |
|
N2: |
2270.77 |
2838.46 |
|
O2: |
374.86 |
535.51 |
|
SO2: |
0,53 |
1,5 |
|
H2O: |
2249,43 |
1807,58 |
|
H2SO4: |
0,53 |
2,3 |
|
Всего |
5014,7 |
5417,22 |
