Синтез, кинетика, термодимика
Известно также, что многие ионы образуют весьма прочные хелатные комплексы. Оказалось, что смолы, синтезированные (а основе хелатообразующих соединений, обладают весьма высокой избирательностью
по отношению к катионам различных металлов. Поведение хелатных ионитов во многих отношениях сходно с поведением обычных хелатных соединений. В частноси, образование хелатов в фазе ионита сильно зависит от рН и поглощение увеличивается с ростом рН раствора.
Аниониты также обладают способностью координационно связывать некоторые катионы, имеющие ярко выраженную тенденцию к образованию анионных комплексов.
1.Периодическая система и её закономерности как методологическая основа неорганического синтеза.
Прежде всего, методологической основой неорганического синтеза являются периодический закон и периодическая система с ее закономерностями (правило об уменьшении стабильности высшей степени окисления с ростом атомного номера в главных подгруппах, диагональное сходство, близость атомных радиусов у атомов элементов пятого и шестого периода за счет f-сжатия, способность элементов к диспропорционированию, полимеризации, комплексообразованию и др.), теории кислотно -основных реакций, теории сольволиза и гидратации, учение о механизмах химических реакций (окислительно-восстановительных, радикальных, обмена лигандов и т.д.), теории химической связи, основные законы химии (при синтезах, например, закон эквивалентов дополняется положением о возможности для многоосновных кислот, многовалентных атомов элементов существования переменного значения кислотно -основного, окислительно-восстановительного эквивалентов).
2.Термодинамический анализ реакций синтеза.
Итак, при термодинамической оценке пригодности для синтеза какой-либо обратимой реакции
![]()
необходимо, чтобы было отрицательным изменение энергии Гиббса реакции
![]()
где
![]()
Если для некоторой реакции К >1, то реакцию можно считать практически необратимой. При значении К >1 ожидается достаточно большой выход продуктов, при К <1 реакция должна протекать в основном "справа налево". Условие К <1 не означает, что реакция синтеза продукта не совершается, в этом случае необходимо вычислять равновесный выход продукта, хотя он может быть и мал.
Уравнение, связывающее изменение энергии Гиббса реакции с константой равновесия
![]()
можно записать в виде
![]()
Подставив в это уравнение величины R = 8,З1 ·10-3 кДж/К ·моль и Т= 298 К, получим
∆G°298 = -2,3 8,31 ·10-3· 298 ·ln K298 = -5,70 ln K298.
При значении K ~107 реакция практически проходит до конца в прямом направлении, поэтому значение ∆G° ~ |40| кДж/моль (5,7ּln107 = 5,7ּ7 ~ 40) можно считать в первом приближении границей возможности или невозможности самопроизвольного протекания реакции. Если ∆G° реакции при данной температуре отрицательно и по модулю больше, чем 40 кДж/моль, то такая реакция может протекать в прямом направлении не только при стандартных, но и при любых других условиях. Если же ∆G° реакции при данной температуре положительно и больше 40 кДж/моль, то такая реакция протекать самопроизвольно ни при каких условиях не может.
Если значение ∆G° реакции по абсолютному значению невелико, то при изменении условий процесс может протекать в том или ином направлении. В этом случае для решения вопроса о направлении самопроизвольного протекания реакции недостаточно определить знак и величину ∆G°, нужно рассчитать значение ∆G○ реакции с учетом содержания во взятой смеси исходных и образующихся веществ.
С помощью известных констант равновесия химических процессов можно решить два вопроса: 1) предсказать направление самопроизвольной реакции при заданных условиях эксперимента и 2) при известных исходном составе системы и константе равновесия можно рассчитать равновесный состав смеси, максимально возможный "выход" продуктов, что важно для реакций синтеза. Рассмотрим это на примере расчета газовых реакций.
При решении первого вопроса удобно ввести понятие кажущейся константы равновесия Q как отношения концентраций продуктов к концентрациям реагентов, но не обязательно относящееся к равновесным условиям. Для нахождения Q можно взять отношение, например, начальных концентраций компонентов (C°). Так, для реакции
![]()
![]() ,
, 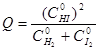
Если имеется больше молекул исходных реагентов, чем должно быть при равновесии, то увеличение знаменателя в выражении для Q приводит к тому, что Q <K, и реакция самопроизвольно пойдет в прямом направлении для образования большего количества продукта; при Q >К самопроизвольно протекает обратная реакция, а при Q =К реагенты и продукты находятся в равновесии.
Определение выхода продуктов реакции проводят с использованием таких понятий, как степень диссоциации α, степень превращения γ, число прореагировавших молей ξ.
Степенью диссоциации α называют долю газа, распавшегося на продукты к данному моменту времени. Значение α можно вычислить для известного значения константы равновесия.
Выразив α через Кр (константа равновесия) и давление компонентов P , получим :
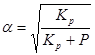
Выражение степени диссоциации компонентов раствора.
3.Кинетический анализ реакций синтеза.
Предметом химической кинетики являются скорости реакций со всеми влияющими на них факторами и интерпретация скорости реакций на основе их механизма. В этом смысле кинетика отличается от термодинамики, в которой рассматриваются начальное и конечное состояния системы вне зависимости от времени протекания этого превращения. Термодинамика обычно рассматривает системы в состоянии равновесия, т. е. в состоянии, в котором скорости прямой и обратной реакций в обратимом процессе равны, что связывает эти две области химии. Однако обратное не верно: скорость реакции нельзя определить только на основе термодинамических данных. Химическую кинетику можно считать более фундаментальной областью науки, но, к сожалению, часто сложность исследуемых процессов делает применение теории химической кинетики довольно трудным.
Рассмотрим равновесие водород -йод в газовой фазе при высокой температуре:
Н2 + I2 = 2НI
Эта реакция протекает при бимолекулярных столкновениях между молекулами йода и водорода, так что стехиометрическое уравнение в этом случае соответствует истинному механизму взаимодействия. Доказательством правильности такого механизма является то, что скорость образования йодистого водорода, как было показано, пропорциональна как концентрации водорода, так и концентрации йода, т. е.
