Синтез, кинетика, термодимика
![]()
Это, однако, исключительный случай, так как обычно стехиометрическое уравнение не описывает механизма реакции, как, например, для значительно более сложной реакции водорода с бромом, скорость которой, как было показано, определяется уравнением:
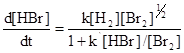
Это можно объяснить следующим механизмом:
![]()
Br + Н2 → НВr + Н (медленная)
Н + Вr2 → НВr + Вr (быстрая)
Н + НВr → Н2 + Вr (быстрая)
Следует отметить, что, зная механизм реакции, не всегда можно дать достаточно определенную интерпретацию экспериментально найденным выражениям для скорости. Иногда с экспериментальными данными согласуются несколько возможных механизмов или вновь полученные данные опровергают ранее принятый механизм.
Очевидно, математическую обработку выражений скоростей реакций через концентрации в определенных степенях
Уравнение:1
![]()
проводить легче, чем для выражений более сложного типа. Только для выражений скорости типа уравнения (1) приемлемо определение порядка реакции n, причем
Уравнение:2
n = n1+n2+n3+……
Из двух рассмотренных выше примеров реакция водорода с йодом -это реакция второго порядка, причем как по водороду, так и по йоду порядок ее равен единице. Понятие порядка реакции неприменимо к взаимодействию водорода с бромом, так как выражение для скорости этого процесса записано не в соответствующей форме.
Если условия проведения реакции таковы, что одна или более концентраций остаются практически постоянными в течение опыта, то эти концентрации можно включить в константу скорости k. В этом случае реакция будет иметь псевдо –n порядок, где n -сумма показателей степеней концентраций, которые в течение эксперимента изменяются. Обычно эти показатели степени -простые положительные числа, но в зависимости от сложности реакции они могут быть дробными или даже отрицательными.
Порядок реакции, определяемый уравнением (2), часто путают с молекулярностью реакции, которая определяется числом молекул, участвующих в элементарном процессе столкновения. Таким образом, молекулярность - это теоретическое понятие, проистекающее из принятого механизма реакции, тогда как порядок - величина эмпирическая; эти две величины могут различаться. Однако бимолекулярные реакции обычно имеют второй порядок, а тримолекулярные реакции -третий порядок, но обратное утверждение не всегда верно. Реакция, которая иллюстрирует только что сказанное, -это окисление ионов Fe2+ перекисью водорода. Стехиометрическое уравнение ее выглядит так:
2Fr2+· aq + Н2О2 → 2Fe3+ · aq + 2OH-
Показано, что выражение для скорости этой реакции
![]()
т. е. реакция имеет второй порядок. Схему протекания реакции лучше всего можно представить следующими стадиями:
Fe2+· aq + Н2О2 ![]() Fe3+ • ао+ОН" +ОН
Fe3+ • ао+ОН" +ОН
и![]()
Fe2+ · aq + OH- ![]() Fe3+· aq + OH-
Fe3+· aq + OH-
где
k1= 60 л/моль · сек и k2 = 60 000 л/моль · сек
Так как суммарная реакция состоит из двух последовательных бимолекулярных стадий, то какую -либо молекулярность стехиометрическому уравнению приписать нельзя. Эта схема также иллюстрирует тот факт, что скорость всего процесса определяет самая медленная стадия, так как константа скорости суммарного процесса - это константа скорости первой, более медленной бимолекулярной стадии (т. е. k = k1). Вторую стадию в этой схеме можно использовать как пример реакции с псевдопорядком.
Для объяснения экспериментальных данных по механизмам реакций широко используют явление изотопного замещения. Так, образец, содержащий радиоактивные ионы Fe2+, можно обработать нерадиоактивным образцом, содержащим ионы Fe3+, и количество полученных радиоактивных ионов Fe3+ можно измерить в зависимости от времени. Уравнение Маккея
![]()
связывает скорость реакции R (т.е. скорость обмена радиоактивностью) с начальными концентрациями a и b реагентов и измеренными радиоактивностями х и ![]() первоначально неактивной формы (в данном случае Fe3+) в моменты времени t и
первоначально неактивной формы (в данном случае Fe3+) в моменты времени t и![]()
![]() . Поэтому такие реакции являются идеальными для исследования влияния температуры, концентрации и других факторов на скорость реакции.
. Поэтому такие реакции являются идеальными для исследования влияния температуры, концентрации и других факторов на скорость реакции.
Таким образом, истинный механизм химических реакций включает мономолекулярные, бимолекулярные или тримолекулярные стадии, по которым реакция идет самопроизвольно при столкновениях между двумя или тремя молекулами. Вероятность одновременного столкновения четырех или более молекул настолько мала, что ею можно пренебречь. Однако можно легко показать, что не все столкновения приводят к химическому взаимодействию. Основными ограничениями, которые лимитируют эффективность столкновений, являются:
а) ориентационные эффекты; очевидно, сложные молекулы могут вступать в реакцию только тогда, когда они соударяются в определенных положениях и в соприкосновение приходят реакционноспособные связи или неподеленные пары электронов. Стерический фактор p показывает, какая часть общего числа соударений приходится на столкновения молекул с такой ориентацией;
б) энергия активации; рассмотрим простую реакцию в газовой фазе
![]()
![]()
![]()
Расстояние H -I в молекуле йодистого водорода равно 1,61 Å и диаметр молекулы равен 3,5 Å.Этот диаметр также должен быть равен расстоянию между двумя атомами водорода или двумя атомами йода в соударяющихся молекулах (удвоенный вандерваальсов радиус; разд. 4.2). Естественно, это расстояние велико по сравнению с расстояниями в молекулах водорода (0,74 Å) и йода (2,67 Å). Следовательно, соударения должны обладать достаточной энергией, чтобы вызвать сжатие молекул НШ, после чего составляющие атомы имели бы возможность подойти друг к другу достаточно близко и вызвать распад этих молекул на водород и йод. Необходимую для этого энергию называют энергией активации реакции, и только те столкновения, которые имеют это минимальное количество энергии, будут эффективными. Часть таких столкновений определяется выражением ![]() , где Еa -энергия активации столкновений на один моль. Константа скорости определяется уравнением Аррениуса
, где Еa -энергия активации столкновений на один моль. Константа скорости определяется уравнением Аррениуса
