Синтез, кинетика, термодимика
![]()
где Z - общее число столкновений между реагирующими молекулами в единичном объеме за одну секунду. Такое простое изложение теории соударений показывает, что она основана на кинетической теории.
Предполагают, что когда взаимодействуют две молекулы, обладающие необходимой энергией активации, то они вначале образуют активированный комплекс, или переходное состояние, который затем разлагается с конечной скоростью с образованием продуктов реакции. Принимают, что скорость реакции определяется скоростью прохождения через переходное состояние, т. е. скоростью прохождения через потенциальный энергетический барьер.Концентрация активированного комплекса в любой момент определяется его равновесием с исходными молекулами. Высота барьера по отношению к энергии исходного состояния равна энергии активации, а разность между энергиями начального и конечного состояний равна теплоте реакции.
3. Кинетика и механизм неорганических реакций.
С кинетической точки зрения неорганические реакции можно подразделить на две группы:
а) реакции, включающие разрыв и образование ковалентных связей, и
б) реакции, сопровождающиеся простым переносом электронов,
Кроме того, в твердом состоянии реакции протекают еще при перемещении ионов из одной решетки в другую по дефектам решетки. Первый класс реакций можно подразделить на реакции, подобные термическому разложению, рассмотренному ранее, и реакции замещения в координационных соединениях, в которых координированный лиганд замещается другим лигандом из раствора. В общем случае реакции замещения по своему характеру нуклеофильные, так как замещаемый лиганд уносит электронную пару, ранее образовывавшую ![]() -связь металл -лиганд, а замещающий лиганд приносит пару электронов и поэтому занимает положение с низкой электронной плотностью. По аналогии с органическими соединениями эти процессы обозначаются как SN-процессы (нуклеофильное замещение). Возможны два основных пути протекания реакции в зависимости от того, происходит ли предварительная диссоциация реагирующего комплекса (мономолекулярный процесс SN1)
-связь металл -лиганд, а замещающий лиганд приносит пару электронов и поэтому занимает положение с низкой электронной плотностью. По аналогии с органическими соединениями эти процессы обозначаются как SN-процессы (нуклеофильное замещение). Возможны два основных пути протекания реакции в зависимости от того, происходит ли предварительная диссоциация реагирующего комплекса (мономолекулярный процесс SN1)
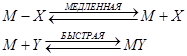
или важной стадией является бимолекулярный процесс замещения, скорость которого зависит от концентрации как комплекса, так и замещающего лиганда (SN2), т. е.
![]()
Следовательно, SN1 -механизм должен привести к активированному комплексу, в котором ион металла имеет меньшее координационное число, чем в исходном комплексе, тогда как SN2 -механизм требует увеличения числа присоединенных лигандов в переходном состоянии. Необходимо далее рассмотреть разность энергии между реагирующим комплексом и этими переходными состояниями. Если в комплексе нет ![]() -связей металл -лиганд, то величину скорости реакции можно предсказать, предполагая электростатическое взаимодействие между ионами металла и лигандами.
-связей металл -лиганд, то величину скорости реакции можно предсказать, предполагая электростатическое взаимодействие между ионами металла и лигандами.
Наличие двух «вакантных» гране -положении в комплексе с конфигурацией плоского квадрата позволяет предположить, что в этом случае более вероятен SN2-механизм. В действительности, однако, почти наверное эти транс- положения не будут свободными, и если нет других лигандов, то они будут заняты молекулами растворителя. Эти молекулы растворителя находятся на большем расстоянии, чем лиганды в плоскости квадрата. Поэтому комплекс будет вести себя во многих отношениях так, как если бы он имел конфигурацию плоского квадрата. Две координированные молекулы растворителя очень подвижны и легко могут быть замещены лигандами из раствора. Это облегчает замещение наиболее подвижного лиганда в плоскости квадрата, например
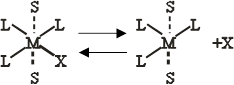 |
Здесь S -молекула растворителя, а рисунок не представляет собой никакой частной стереохимической конфигурации пятикоординационного переходного состояния. К этому переходному состоянию легко присоединяется нуклеофильный реагент У; одновременно комплекс теряет молекулы растворителя и образуется новый комплекс [ML3Y]. Экспериментально было найдено, что уравнение для скорости реакции типа
[ЭIIX4] + Y→ [ЭIIX3Y] + 3
имеет вид
скорость = k1 [комплекс] + k2 [комплекс] [Y]
где k1 -константа скорости реакции первого порядка, которую относят к процессу с SN2 -механизмом; в этом процессе растворитель -нуклеофильная атакующая единица, k2 -константа скорости реакции второго порядка в процессе с SN2 -механизмом, в котором нуклеофильной единицей является Y. Если расположить нуклеофильные реагенты в порядке возрастания k1 или k2 то их реакционная способность по отношению к элементу с положительной степенью окисления II будет увеличиваться в ряду:
H2O ~ OH- < Cl- < Br- ~ NH3 ~ олефин < ру < NO-2 < N-3 < I- ~ SCN- ~ PR3
Очевидно, что по отношению к платине со степенью окисления II большую реакционную способность имеют те лиганды, которые могут быть как σ -донорами, так и π -акцепторами. Платина, занимающая место в конце третьего ряда переходных элементов, имеет несвязанные электроны, необходимые для образования π -связей металл –лиганд. Приведенный выше порядок лигандов определяет также повышение реакционной способности других лигандов, находящихся по отношению к первым в транс -положении. Это явление называют транс -влиянием. Так, в реакции
![]()
для цис –изомера k1 = 1,7 ·10-2 (при 0°), а для транс -изомера k1 = 10 ·10-6 (при 25°), т. е. когда замещаемый лиганд (Cl-) находится в транс -положении по отношению к фосфиновой группе, то его замещение идет намного легче, чем когда он находится в транс -положении по отношению ко второму хлору. Можно ожидать, что в комплексах типа ![]() π -связь металл -лиганд прочнее для цис-, чем для транс -изомера. Два атома фосфора в транс -изомере (предполагается, что они лежат вдоль оси х молекулы) могут использовать для образования π -связи только
π -связь металл -лиганд прочнее для цис-, чем для транс -изомера. Два атома фосфора в транс -изомере (предполагается, что они лежат вдоль оси х молекулы) могут использовать для образования π -связи только ![]() и
и ![]() орбитали, а в цис -изомере
орбитали, а в цис -изомере ![]() и
и ![]() орбитали. Разность сил связей будет максимальной, когда лиганды Х - слабые π -акцепторы, как в случае иона хлора. Когда же подвижные лиганды не могут действовать как π -акцепторы, их различие в проявлении транс -влияния должно иметь электростатическую природу. Это можно объяснить, предположив поляризуемость подвижного лиганда, влияющего на электронное распределение вокруг центрального атома: этот тип индуктивного эффекта мало проявляется в цис -положении (через 90°), но на лиганд в транс -положении подвижный лиганд оказывает наибольшее влияние. Встречаются такие случаи, когда влияние л-связи и электростатического эффекта само по себе мало, но они дополняют друг друга, приводя к довольно сильному суммарному влиянию на транс -положение; это наблюдается, например, для I-. Эти предсказания подтверждаются экспериментально исследованием спектров -ядерного магнитного резонанса и определением энергий связей. Так, общая энергия связи цис -
орбитали. Разность сил связей будет максимальной, когда лиганды Х - слабые π -акцепторы, как в случае иона хлора. Когда же подвижные лиганды не могут действовать как π -акцепторы, их различие в проявлении транс -влияния должно иметь электростатическую природу. Это можно объяснить, предположив поляризуемость подвижного лиганда, влияющего на электронное распределение вокруг центрального атома: этот тип индуктивного эффекта мало проявляется в цис -положении (через 90°), но на лиганд в транс -положении подвижный лиганд оказывает наибольшее влияние. Встречаются такие случаи, когда влияние л-связи и электростатического эффекта само по себе мало, но они дополняют друг друга, приводя к довольно сильному суммарному влиянию на транс -положение; это наблюдается, например, для I-. Эти предсказания подтверждаются экспериментально исследованием спектров -ядерного магнитного резонанса и определением энергий связей. Так, общая энергия связи цис -![]() больше, чем энергия транс -изомера, примерно на 10 ккал.
больше, чем энергия транс -изомера, примерно на 10 ккал.
