Увеличение степени защиты стали от коррозии в нейтральных и кислых средах
В данной работе предлагается использовать борат метилфосфит в качестве ингибитора коррозии в нейтральных средах, получаемого по схеме [24]:
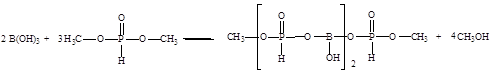
Для расчета термодинамических параметров процесса необходимо знать зависимость теплоемкости от температуры для каждого соединения вида:
Cp = f(t) = Δa + Δb T + Δc`/T2 + ΔcT2, (4)
где a, b, c, c`- коэффициенты (табличные значения для Н3ВО3 и С2Н7РО3), а также значения H298, S298 .
Поскольку значения указанных величин для целевого продукта частично неизвестны, рассчитаем их, используя методы, рассмотренные в разделе 2.1.1.
Получим зависимость теплоемкости от температуры, используя метод Неймана - Коппа. В этом случае используется правило сложения теплоемкостей элементов, составляющих соединение:
Cp = ![]() ,
,
где cp – теплоемкость соединения, ср,i – теплоемкость составляющего его i – го элемента (с учетом количества атомов).
Таблица 2.1 – Исходные данные для расчета теплоемкости борат метилфосфита
|
Элемент (вещество) |
ср = f(T) |
Литературный источник | ||
|
а |
b ·103 |
c`·10-5 | ||
|
Р |
16,961 |
14,901 |
- |
[17] |
|
C |
17,17 |
4,27 |
-8,79 |
[16] |
|
Н2 |
27,3 |
3,27 |
0,5 |
[17] |
|
O2 |
29,98 |
4,2 |
-1,7 |
[16] |
|
В |
16,056 |
10,01 |
-6,28 |
[15] |
Δa =![]() ;
;
Δa =16,961·3 + 17,17·2 + 27,3·5,5 + 29,98· 5,5 + 16,056·2 = 432,375
остальные коэффициенты ряда рассчитываются аналогично:
Δb = 114,338·10-3
Δc` = –36,74·105
cp = 432,375 + 114,338·10-3·Т – 36,74·105/Т2
Определение зависимости теплоемкости от температуры были произведены экспериментальным путем.
Чтобы сравнить значения теплоемкости, рассчитанные с помощью рассмотренного метода, и полученные экспериментально [24], представим результаты расчетов, выполненных аналогично рассмотренным, в виде таблицы, а затем построим графики зависимости теплоемкости от температуры.
Таблица 2.2 – Результаты расчета изобарной теплоемкости
|
Температура Т,К |
Расчет по методу Неймана-Коппа Ср, Дж/(моль·К) |
Экспериментальное определение Ср, Дж/(моль·К) |
|
353 |
443,26 |
430,32 |
|
363 |
446,00 |
435,15 |
|
373 |
448,62 |
442,45 |
|
383 |
451,12 |
448,59 |
|
393 |
453,53 |
456,87 |
|
403 |
455,84 |
459,25 |
|
413 |
458,06 |
462,37 |
|
423 |
460,21 |
464,01 |
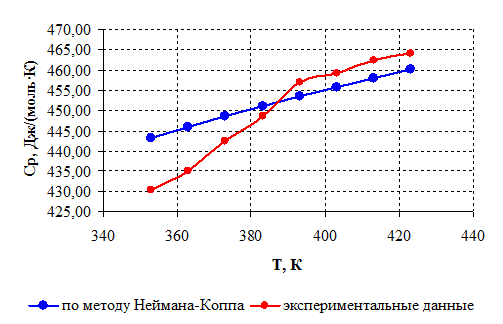
Рисунок 2.1 – Зависимость теплоемкости борат метилфосфита от температуры.
Как видно из графиков (рисунок 2.1) , рассчитанная по методу Неймана-Коппа теплоемкость несколько различается, однако максимальная разница между значениями не превышает допустимых 8 % [18] (для температуры 353 К, где разница максимальна, она составляет 3,1 % по отношению к меньшему значению теплоемкости).
Таким образом, доказана возможность использования вышеприведенного метода для дальнейших расчетов в рассматриваемом интервале температур.
Получим зависимости энтальпии и энтропии вида:
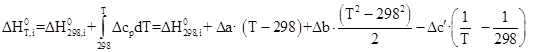
![]()
![]()
![]()
Согласно [11] ![]() = –4049,34 кДж/моль (вычислено по энергиям связей), таким образом, задача сводится к определению ΔS0298, i .
= –4049,34 кДж/моль (вычислено по энергиям связей), таким образом, задача сводится к определению ΔS0298, i .
Как было сказано выше все эмпирические методы расчета энтропии жидких веществ не подходят для данного соединения, поэтому воспользуемся полуэмпирической зависимостью [18]:
![]()
Определим основные термодинамические параметры основной реакции. Данные для термодинамического расчета реакции синтеза представлены в таблице 2.3.
Таблица 2.3 – Термодинамические данные веществ участников реакции
|
Вещество |
ср = f(T) |
ΔН0 298, кДж/моль |
ΔS0298 Дж/К·моль | |||
|
a |
b ·103 |
c`·10-5 |
с·106 | |||
|
H3BO3 |
81,39 |
– |
– |
– |
-1094,89 |
88,8 |
|
C2H7PO3 |
79,39 |
21,62 |
-19,21 |
– |
-784,14 |
67,70 |
|
Борат метилфосфит |
432,375 |
114,348 |
-36,74 |
– |
-4049,34 |
595,11 |
|
СН3ОН |
15,29 |
105,269 |
– |
-31,07 |
-79,634 |
57,29 |
|
Итого |
92,59 |
470,56 |
20,90 |
-31,07 |
174,32 |
443,57 |
