Увеличение степени защиты стали от коррозии в нейтральных и кислых средах
Зависимости энтальпии и энтропии реакции от температуры:
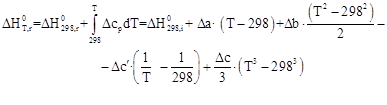
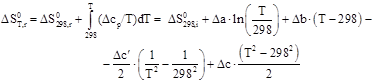
![]()
![]()
Руководствуясь ранее приведенным порядком расчета подобных зависимостей, получим:
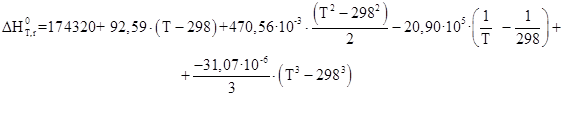
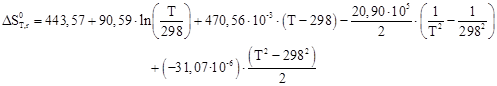
Результаты вычислений представлены в таблице 2.4.
Таблица 2.4 – Результаты расчета термодинамических параметров
|
Температура, К |
Дж/моль |
ΔST,r, Дж/моль·К |
ΔGт, r, Дж/моль |
ln Кр |
Kр |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
353 |
188751,92 |
487,96 |
16501,11 |
-5,62 |
0,0036 |
|
363 |
191485,71 |
495,60 |
11583,21 |
-3,84 |
0,0215 |
|
373 |
194255,56 |
503,13 |
6589,50 |
-2,12 |
0,1194 |
|
383 |
197062,08 |
510,55 |
1521,03 |
-0,48 |
0,6202 |
|
393 |
199905,84 |
517,88 |
-3621,21 |
1,11 |
3,0292 |
|
403 |
202787,32 |
525,12 |
-8836,29 |
2,64 |
13,9750 |
|
413 |
205706,96 |
532,28 |
-14123,34 |
4,11 |
61,1406 |
|
423 |
208665,15 |
539,35 |
-19481,56 |
5,54 |
254,5595 |
По результатам вышеприведенных расчетов построим графики соответствующих зависимостей.
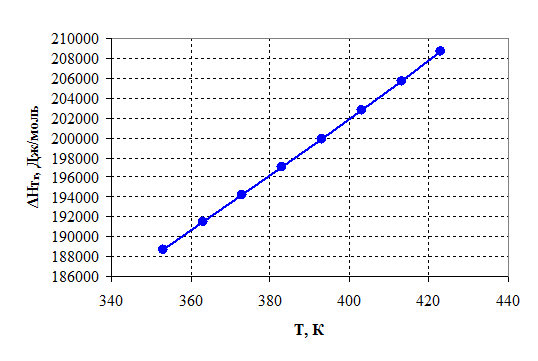
Рисунок 2.2 – Зависимость энтальпии от температуры.
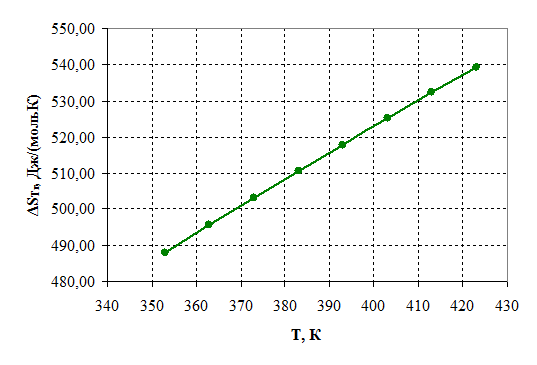
Рисунок 2.3 – Зависимость энтропии от температуры.
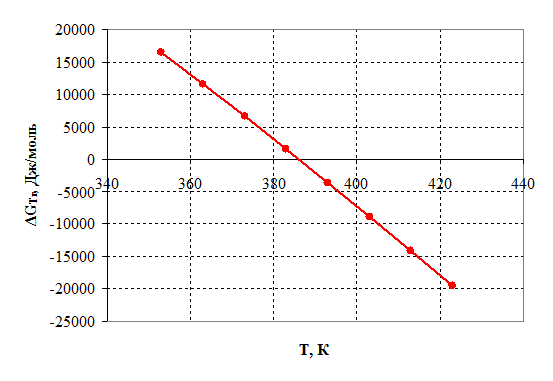
Рисунок 2.4 – Зависимость энергии Гиббса от температуры.
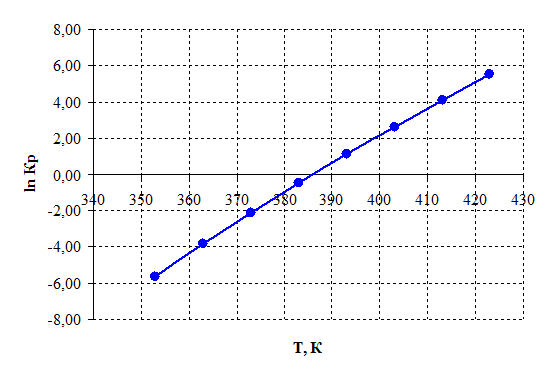
Рисунок 2.5 – Зависимость логарифма константы равновесия от температуры.
По приведенным результатам расчета термодинамических характеристик рассматриваемой реакции можно сделать следующие выводы:
1) Так как ![]() >0, то реакция эндотермическая
>0, то реакция эндотермическая
2) Энергия Гиббса становится отрицательной при температуре 385 К, следовательно, процесс термодинамически возможен, только при условие, что температура реакции больше 385 К, далее видно, что с повышением температуры, термодинамическая вероятность протекания процесса в прямом направлении линейно возрастает. На практике процесс осуществляется при 390 – 400 К.
3) При температурах больше 385 К константа равновесия Кр >1 и далее с повышением температуры экспоненциально возрастает, тем самым равновесие смещается в сторону продуктов реакции.
3. Расчет материального баланса
Расчет материального баланса будем вести, приняв производительность установки 5 т/сут. Синтез ведется в реакторе идеального смешения периодического действия, поэтому все расчеты будем вести на один цикл.
В процессе производства целевого продукта – борат метилфосфита протекают следующие реакции [24]:
Основная реакция:
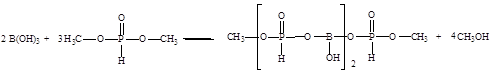
Побочная реакция:
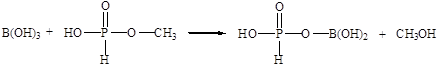
Основные данные для расчета материального баланса сведем в таблицу:
Таблица 3.1 – Основные данные для расчета
|
Статьи |
Размерность |
Величина |
|
Производство по борат метилфосфиту, П |
т/сут |
5 |
|
Время одного цикла |
ч |
3 |
|
Технологический выход, f |
% |
97 |
|
Молярное соотношение Н3ВО3/ДМФ |
доли |
1: 3 |
|
Степень превращения, х |
% |
98 |
|
Селективность основной реакции, Ф |
% |
98,3 |
|
Состав исходных реагентов, W: |
% | |
|
Борная кислота хч Н3ВО3 – борная кислота (А) Na2SO4 – сульфат натрия |
98 2 | |
|
Диметилфосфит хч С2Н7РО3 – диметилфосфит (В) СН5РО3– монометилфосфит (С) |
99 1 | |
|
Молярные массы, М: Н3ВО3 – борная кислота Na2SO4 – сульфат натрия С2Н7РО3 – диметилфосфит (ДМФ) СН5РО3– монометилфосфит (ММФ) Борат метилфосфит (целевой) (D) Борат метилфосфит (побочный) (E) CH3OH – метанол (F) |
кг/кмоль |
62 142 110 96 326 126 32 |
