Физическая химия
1. Формулировка задания
Исследование 1
Для реакции
H2S(г) + CO2(г) = H2O(г) + COS(г)
1.1. Составить уравнение зависимости от температуры величины теплового эффекта ∆Н0т=f(T) и изменения энтропии ∆S0T = f(T).
1.2. Вычислить величины ∆Ср, ∆Н0т, ∆S0т, ∆G0т и lnKp при нескольких температурах. Полученные значения используются при построении графиков в координатах ∆Ср – Т; ∆Н0т – Т; ∆S0т – Т; ∆G0т – Т; и lnKp – 1/Т.
1.3. Пользуясь графиком lnKp – 1/Т, вывести приближенное уравнение вида lnKp = А/Т + В, где А, В – постоянные.
Исследование 2
2.1. Используя правило фаз Гиббса для рассматриваемой системы определить количество фаз, независимых компонентов и число степеней свободы.
2.2. Определить возможное направление протекания исследуемой реакции и равновесный состав газовой фазы при давлении 1013 гПа, и температуре 1300 К. При решении задач использовать выведенное в исследовании 1 уравнение lnKp = А/Т + В и данные об исходном составе газовой фазы.
2.3. Установить направление смещения состояния равновесия рассматриваемой системы при увеличении давления (при постоянной температуре) и при увеличении температуры (при постоянном давлении).
2. Исходные данные
Исследование 1
|
Вариант – номер задания | Схема реакции аА + bB = cC + dD |
Интервал температур Тн - Тк | |||
| Компоненты | |||||
| А | В | С | D | ||
| 1-6 | Н2S(г) | CO2(г) | H2O(г) | COS(г) | 800-1700 |
Исследование 2
| № п/п | Шаг в градусах, Т | Фактический состав смеси, об. % | Общее давление, Р, гПа | Темпера-тура, К | |||
| Компоненты | |||||||
| А | В | С | D | ||||
| 1-6 | 100 | 10 | 30 | 30 | 30 | 1013 | 1300 |
3. Решение задания
3.1. Исследование 1
Для реакции
H2S(г) + CO2(г) = H2O(г) + COS(г)
Составить уравнение зависимости от температуры величины теплового эффекта ∆Н0т=f(T) и изменения энтропии ∆S0T = f(T). Вычислить величины ∆Ср, ∆Н0т, ∆S0т, ∆G0т и lnKp при нескольких температурах. Полученные значения используются при построении графиков в координатах ∆Ср – Т; ∆Н0т – Т; ∆S0т – Т; ∆G0т – Т; и lnKp – 1/Т.
Для удобства последующих расчетов, составим таблицу исходных данных, используя справочный материал.
Таблица 1.
Исходные данные для термодинамического исследования реакции H2S + CO2= H2O + COS
| № п/п | Вещество | ∆Н0298 кДж/моль | ∆S0298 кДж/моль | Коэффициенты в уравнении а + вТ + с/Т-2, дж/моль∙К | ||
| а | В∙103 | с/ ∙10-5 | ||||
| 1 | Н2S | -20,60 | 205,70 | 29,37 | 15,40 | - |
| 2 | CO2 | -393,51 | 213,66 | 44,14 | 9,04 | -8,54 |
| 3 | H2O | -241,81 | 188,72 | 30,00 | 10,71 | 0,33 |
| 4 | COS | -141,70 | 231,53 | 48,12 | 8,45 | -8,20 |
3.1.1. Расчет теплового эффекта реакции
Зависимость теплового эффекта реакции от температуры определяется законом Кирхгофа:
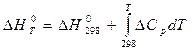 (1)
(1)
где: ∆Н0298 – стандартный тепловой эффект реакции при 298 К;
∆СР - изменение теплоемкости системы в результате протекания реакции.
Последняя величина рассчитывается по уравнению:
![]() (2)
(2)
где Ср,i – мольная изобарная теплоемкость i-го вещества;
ni – стехиометрический коэффициент i-го вещества в уравнении реакции (1).
После подстановки зависимостей Ср,i в выражение (2), оно имеет вид
∆Ср,i = ∆а + ∆bТ + ∆с/Т-2 (3)
где ![]() (4)
(4)
∆b и ∆с/ рассчитываются аналогично.
