Физическая химия
Таблица 6.
| № п/п | Шаг в градусах, Т | Фактический состав смеси, об. % | Общее давление, Р, гПа | Темпера-тура, К | |||
| Компоненты | |||||||
| А | В | С | D | ||||
| 1-6 | 100 | 10 | 30 | 30 | 30 | 1013 | 1300 |
3.2.1. Определение количества фаз независимых компонентов и степеней свободы
Рассматриваемая система состоит из одной фазы – газообразной, представляющей смесь газов H2S, CO2, H2O, COS. Таким образом, ф = 1.
Число независимых компонентов k равно наименьшему числу веществ, необходимых для выражения состава всех фаз системы. Это число определяют, как общее число веществ в системе m за вычетом числа связей между ними r. Связь между веществами, входящими в рассматриваемую систему выражается уравнением реакции H2S(г) +CO2 (г) =H2O(г) + COS(г).
Следовательно:
k = m – r = 4 – 1 = 3 (15)
Число степеней свободы с (вариантность системы) равно числу независимых переменных системы (давления, температуры, концентрации компонентов), которые можно изменить в некоторых пределах так, чтобы число и природа фаз оставались прежними. По правилу фаз Гиббса:
с = k + n – ф (16)
где n – число внешних параметров, влияющих на состояние равновесия системы. Обычно это давление и температура, то есть n = 2. Для рассматриваемой системы:
с = k + 2 – ф = 3 + 2 – 1 = 4
3.2.2. Определение возможного направления протекания реакции
Для решения этой задачи воспользуемся уравнением Вант-Гоффа:
∆G = (lnПр – lnКр) (17)
где Пр – произведение фактических парциальных давлений газовых компонентов реакции; Кр – константа равновесия реакции при данной температуре.
Напомним, что в соответствии со вторым законом термодинамики и в изобарно – изотермических условиях возможно самопроизвольное протекание процессов, сопровождающихся уменьшением энергии Гиббса системы:
∆G < 0 (18)
В применении к химической реакции это означает, что процесс самопроизвольно может идти слева направо при ∆G < 0 и справа налево при ∆G>0.
Из уравнения (18) следует, что первое условие (∆G < 0) выполняется при Пр<Кр, а второе (∆G>0) – при Пр>Кр.
Таким образом, для ответа на поставленный вопрос необходимо рассчитать константу равновесия при заданной температуре (Т = 1300 К) и величину Пр при содержании H2S – 10 % об., CO2 – 30%, H2O – 30% и COS – 30%, а также общем давлении, равном 1013 гПа. Применяя уравнение (14) найдем величину Кр при 1300 К:
lnKp1300 = (-3765,76 / Т) + 0,33 = (-3765,76 / 1300) + 0,33 = -2,56
Кр1300 = 0,077
В соответствие с уравнением реакции, произведение фактических парциальных давлений запишется в виде
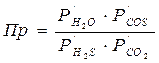 (19)
(19)
где Р/H2S, Р/CO2, Р/H2O, Р/COS – фактические парциальные давления, выраженные в относительных единицах. Для нахождения относительного давления следует давление, выраженное в Паскалях разделить на стандартное давление, равное 101325 Па. Общее давление, выраженное в относительных единицах:
![]()
По закону Дальтона, парциальное давление компонента газовой смеси равно общему давлению, умноженному на объемную долю данного компонента:
Р/H2S = Р/общ ∙0,1 = 0,1
Р/CO2= Р/общ ∙0,3 = 0,3
Р/H2O = Р/общ ∙0,3 = 0,3
Р/COS = Р/общ ∙0,3 = 0,3
Отсюда произведение парциальных давлений согласно уравнению (19):
![]()
Так как Пр > Кр (3>-2,56), то при заданных условиях ∆G>0 и возможное направление реакции – справа налево, то есть будет происходить диссоциация продукта и будут увеличиваться содержания исходных веществ до тех пор, пока отношение парциальных давлений вновь станет равным Кр.
3.2.3. Определение равновесного состава газовой смеси
Равновесный состав газовой смеси рассчитывается из выражения константы равновесия рассчитываемой реакции:
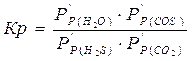
где Р/Р(Н2S), Р/Р(CO2), Р/Р(H2O), Р/Р(COS) – равновесные парциальные давления, выраженные в относительных единицах.
Выше мы выяснили, что при указанных условиях возможно протекание реакции справа налево. Следовательно, при достижения состояния равновесия, содержание Н2S и CO2 увеличится, а Н2О и СOS уменьшится по сравнению с исходным.
В пункте 3.2.1. мы показали, что содержание H2S, CO2, H2O и COS в равновесной газовой смеси есть функция только температуры и давления. Отсюда следует, что при данной температуре и давлении они зависят от исходного состава смеси. Обозначим через (0,1+х) долю H2S, (0,3+х) - CO2, (0,3-х) - H2O и (0,3-х) для COS.
Константа равновесия при Т=1300 К запишется в виде:
![]()
После преобразований имеем уравнение:
0,923 ∙ х2 – 0,6308 ∙ х + 0,08769 = 0
Решая его получим два корня:
![]()
х1 = 0,489 х2 = 0,194
Физический смысл имеет х2 = 0,194
Содержание этих газов, выраженные в объемных процентах, будут равны мольным долям, умноженным на 100%.
об.% H2S = (0,1+0,19)*100 = 29%
об.% CO2 = (0,3+0,19)*100 = 49%
об.% H2O = (0,3-0,19)*100 = 11%
об.% COS = (0,3-0,19)*100 = 11%
3.2.4. Установление направления смещения равновесия
Качественно направления смещения состояния равновесия определяются принципом Ле Шателье: «Если на систему, находящуюся в равновесии оказывается воздействие, то в системе происходит такое смещение равновесия, которое ослабляет это воздействие».
Реакция H2S + CO2 = H2O + COS идет с поглощением тепла (∆Н0т > 0), следовательно, при повышении температуры должно смещаться слева направо, так как образование конечных продуктов из исходных веществ является эндотермическим процессом и его протекание ослабляет произведенную на систему воздействие. Этот вывод согласуется с характером изменения величины Кр в зависимости от температуры (см. табл. 5).
Если протекание реакции сопровождается изменением числа молей газообразных продуктов (∆n≠0), то давление влияет на состояние равновесия. Увеличение давления смещает равновесие в сторону веществ, занимающих меньший объем.
