Физическая химия
∆а = а(н2о) + а(cos) – (а(н2s) + a(co2)) = 30,00+48,12-(44,14+29,31) =
= 78,12 – 73,51 = 4,61 Дж/моль∙К
∆b = b(н2о) + b(cos) – (b(н2s) + b(co2)) =
= 8,45∙10-3 +10,71∙10-3 – (9,04∙10-3 + 15,40∙10-3) = -5,28∙10-3
∆сi = с/(н2о) + с/ (cos) – с/ (co2) = -8,20∙105 + 0,33∙105 + 8,54∙105 = 0,67∙105
Значение ∆Н0298 определяется по стандартным теплотам образования ∆Н0298,i:
![]() (5)
(5)
Значения теплот образования соответствующих веществ приведены в табл. 1. После их подстановки в уравнение (5) имеем
∆Н0298 = -141,70 - 241,81 – (-393,51 – 20,60) = -383,51+417,11 = 33,6 кДж =
= 33600 Дж
В соответствии с заданием необходимо рассчитать тепловые эффекты в интервале температур 800 – 1700 К при шаге температуры 100 К. После подстановки значений ∆Ср из уравнения (3) в (1) получим тепловые эффекты:
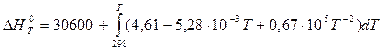
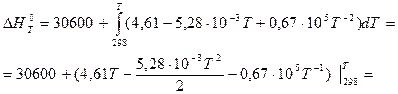
= 30600+((4,61Т - 2,64∙10-3 Т2 – 0,67∙105 Т-1)-(1373,78 - 243,44 – 224,83)) =
=(30600 - 905,51) + 4,61Т – 0,67∙105 Т-1 – 2,64∙10-3Т2
∆Н0т = 4,61Т – 0,67∙105Т-1 – 2,64∙10-3Т2 + 29694,49
∆Н0800 = 4,61∙800 – 0,67∙105/800 – 2,64∙10-38002 + 29694,49 =
= 3688 – 83,75 – 1689,6 + 29694,49 = 31609,15 Дж
……………………………………………………………………….
∆Н01700 = 4,61∙1700 – 0,67∙105/1700 – 2,64∙10-3∙17002 + 29694,49 = 29862,48 Дж
Значения тепловых эффектов приведем в табл. 2.
Таблица 2.
Величина ∆Н0т при различных температурах для
реакции H2S + CO2= H2O + COS
|
Т, К |
800 |
900 |
1000 |
1100 |
1200 |
1300 |
1400 |
1500 |
1600 |
1700 |
|
∆Н0т, Дж | 31609 | 31631 | 31597 | 31510 | 31369 | 31174 | 30926 | 30625 | 30270 | 29862 |
Зависимость ∆Н0т - Т, построенная по данным табл. 2 представлена на рис. 1 и позволяет найти на только значение теплового эффекта при Людой температуре в заданном интервале, но и легко определить величину ∆СР. Например, требуется определить ∆СР рассматриваемого процесса при 1300 К. Из дифференциальной формы закона Кирхгофа:
![]()
следует, что тангенс угла наклона касательной, проведенной к кривой при температуре 1300К дает величину ∆СР (см. рис. 1). Чтобы определить численное значение ∆СР возьмем на касательной две произвольные точки «а» и «b». Можно записать:
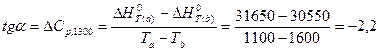 Дж/К
Дж/К
Расчет ∆СР,1300 по уравнению (3) дает близкие к найденному графическим способом значения:
∆СР,1300 = 4,61 - 6,86 + 0,04 = -2,21 Дж/К
3.1.2. Расчет изменения энтропии реакции
Изменение Энтропии системы в результате протекания процесса определяется по уравнению:
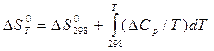 (6)
(6)
В этом уравнении ∆S0298 – стандартное изменение энтропии для реакции при 298 К, определяемое по мольным энтропиям веществ ∆S0i,298:
![]() (7)
(7)
Значение ∆S0298 для соответствующих веществ приведены в табл. 1, после их подстановки в уравнение (7) получим:
∆S0298 = ∆S0298(н2о) + ∆S0298(cos) – (∆S0298(н2s) + ∆S0298(co2)) =
= 231,53 + 188,72 - (213,66+205,70) = 0,89 Дж/К
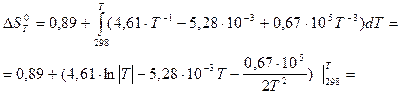
= 0,89 +(4,61∙ln│Т│- 5,28∙10-3∙Т – 0,335∙105∙Т-2) – (26,3 – 1,57 – 0,38)=
= 4,61∙ln│Т│- 5,28∙10-3∙Т – 0,335∙105∙Т-2 – 23,46
Рассчитаем изменение энтропии в заданном интервале температур и полученные данные сведем в табл. 3.
∆S0800 = 4,61∙ln│800│- 5,28∙10-3∙800 – 0,335∙105∙800-2 – 23,46 = 3,079 Дж/К
…………………………………………………………………………………
∆S01700 =4,61∙ln│1700│–5,28∙10-3∙1700–0,335∙105∙1700-2 – 23,46 = 1,843 Дж/К
Таблица 3.
Значения изменения энтропии (∆S0т ) при различных Т,К
|
Т, К |
800 |
900 |
1000 |
1100 |
1200 |
1300 |
1400 |
1500 |
1600 |
1700 |
|
∆S0т, Дж | 3,08 | 3,11 | 3,07 | 2,99 | 2,87 | 2,71 | 2,53 | 2,32 | 2,09 | 1,84 |
По данным табл. 3 построим график ∆S0т = f(Т) (см. рис. 2).
3.1.3. Расчет изменения стандартной энергии Гиббса
При расчете изменения стандартной энергии Гиббса для реакции
H2S + CO2= H2O + COS
воспользуемся уравнением Гиббса-Гельмгольца:
![]() (8)
(8)
Найденные величины изменения стандартной энергии Гиббса приведем в табл. 4, по данным которой построим зависимость ∆G0т = f(Т) (см. рис. 3).
∆G0800 = 31609,15 – 800*3,08 = 29145,15
…………………………………………………………………………………
∆G01700 = 29862,49 – 1700*1,84 = 26734,49
Таблица 4.
Значения изменения стандартной энергии Гиббса (∆G0т ) при различных Т,К
| Т, К | 800 | 900 | 1000 | 1100 | 1200 | 1300 | 1400 | 1500 | 1600 | 1700 |
|
∆G0т, Дж | 29145,38 | 28835,54 | 28526,25 | 28222,9 | 27929,88 | 27650,79 | 27388,73 | 27146,25 | 26925,61 | 26734,49 |
