Физическая химия
В выбранном интервале температур ∆G0т имеет положительные значения. Это значит, что при стандартных состояниях веществ (активности всех веществ равны единице) возможное протекание процесса – справа налево.
3.1.4. Расчет константы равновесия
Для реакций, в которых участвуют только газы или газы и конденсированные фазы, представляющие собой чистые вещества, константу равновесия выражают обычно через равновесные парциальные давления (Pi) и обозначают символом Кр.
Константа равновесия связана с изменением стандартной энергии Гиббса соотношением:
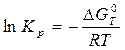 (9)
(9)
После подстановки выражения (8) в уравнение (9) получим:
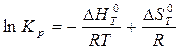 (10)
(10)
Можно полагать, что в сравнительно небольшом интервале температур тепловой эффект реакции (∆Н0т) и изменение энтропии (∆S0т) практически постоянные величины (это подтверждают и результаты табл. 2 и 3). Отсюда уравнение можно записать в виде:
![]() (11)
(11)
где А и В – постоянные, которые соответственно равны:
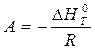 (12)
(12)
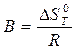 (13)
(13)
Уравнение (11) отвечает линейной зависимости lnKP = f(1/T). Определим коэффициенты А и В графически. С этой целью по уравнению (9) и данным табл. 4 рассчитаем величину lnKP, в заданном интервале температур. Например для температуры 900 К:
![]()
Константа равновесия, соответствующая полученному значению lnKp900 вычисляется следующим образом:
![]()
Аналогично рассчитываем lnKP и КР при других температурах. Полученные значения этих величин вместе со значениями сведем в табл. 5.
Таблица 5.
Константы равновесия для реакции H2S+CO2=H2O+ COS при различных температурах (Т)
|
Т, К |
800 |
900 |
1000 |
1100 |
1200 |
1300 |
1400 |
1500 |
1600 |
1700 |
|
1/Т∙103 | 1,25 | 1,11 | 1,00 | 0,90 | 0,83 | 0,77 | 0,71 | 0,67 | 0,62 | 0,59 |
|
lnKP | -4,38 | -3,86 | -3,43 | -3,09 | -2,80 | -2,56 | -2,35 | -2,18 | -2,03 | -1,89 |
|
KP | 0,012 | 0,021 | 0,032 | 0,046 | 0,061 | 0,077 | 0,095 | 0,113 | 0,132 | 0,151 |
Реакции, для которых значения константы равновесия находятся в пределах от 10-3 до 103 (10-3 < KP < 103), принято считать практически обратимыми. Для реакции (1) в интервале 800 – 1700 К 10-3 < KP < 103 то есть это практически обратимая реакция. Увеличение Кр с ростом температуры означает, что равновесие реакции (1) сдвигается слева направо.
По данным табл. 5 строим график зависимости lnKP =f(1/Т), приведенной на рис. 4.
Точки на графике практически ложатся на прямую, тангенс угла которой к оси абсцисс численно равен коэффициенту А в уравнении (11). Для нахождения величины тангенса возьмем на прямой, как это показано на рис. 4, произвольно две точки «А» и «В» и определим численные значения их ординат и абсцисс. Можно записать:
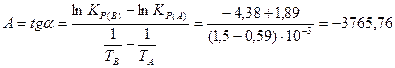
Для определения численного значения В поступим следующим образом. Из табл. 5 возьмем значение lnKP = при 1700 К (-1,89), подставим его вместе с численным коэффициентом А (-3765,76) найденным ранее в уравнение (11), предварительно выразив его через В.
В = lnKp – A/T = -1,89 – (-3765,76 / 1700) = 0,33
Итак, приближенное уравнение зависимости константы равновесия от температуры имеет вид:
lnKp = (-3765,76 / Т) + 0,33 (14)
Последнее уравнение позволяет рассчитать значение Кр при любой температуре, если последняя находится в заданном интервале (то есть в пределах 800 – 1700 К) или незначительно выходит за этот интервал.
По значениям коэффициентов А и В рассчитаем величину среднего теплового эффекта реакции (∆Н0т) и изменения энтропии (∆S0т). Согласно уравнениям (12) – (13) имеем:
∆Н0т = -А∙R = -(-3765,76) ∙ 8,31 = 31293,45 Дж
∆S0т = В ∙ R = 0,33 ∙ 8,31 = 2,74 Дж/К
Полученные данные неплохо согласуются с данными, приведенными в табл. 2 и 3. Если подсчитать средние значения величин, приведенных в табл. 2 и 3, то они будут приблизительно равны полученным выше результатам.

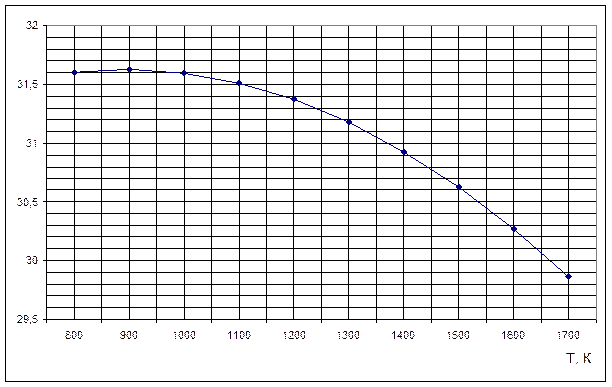
Рисунок 1. Зависимость теплового эффекта реакции H2S+CO2=H2O+ COS от температуры
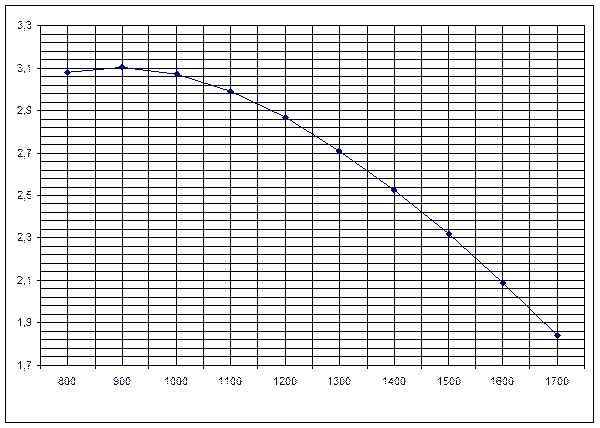
Рисунок 2. Зависимость изменения энтропии от температуры реакции H2S+CO2=H2O+ COS
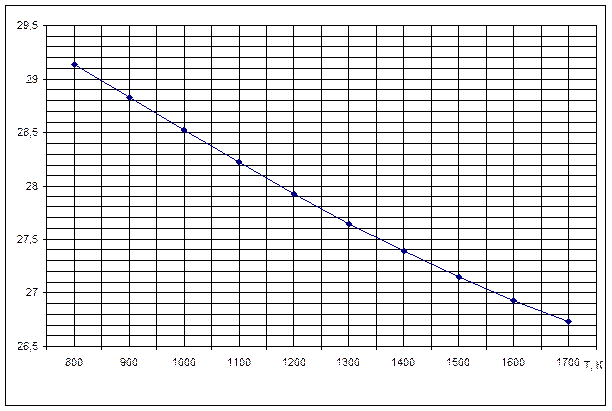
Рисунок 3. Зависимость изменений стандартной энергии Гиббса от температуры реакции H2S+CO2=H2O+ COS
Рисунок 4. Зависимость lnKp от обратной температуры для реакции H2S+CO2=H2O+ COS
3.2. Исследование 2
В этом исследовании нужно для рассматриваемой системы рассчитать число степеней свободы, определить возможное направление протекания реакции при заданных условиях, а также состав газовой фазы системы в состоянии равновесия. Соответствующие условия – давление, температура, исходный состав газовой смеси приведены в табл. 6.
