Аналогии в курсе физики средней школыРефераты >> Педагогика >> Аналогии в курсе физики средней школы
Графики аналогичны графику представленным на рис.11, только вместо величин x, v, F ставятся аналогичные им величины q, i, U,то есть ![]() . Для них
. Для них
![]()
i=q'; ![]()
![]()
![]()
Затем поясняют, что при максимальном значении напряжения сила тока в цепи равна нулю и наоборот. Для этого на механической аналогии показывается, что при максимальном значении действующей силы скорость равна нулю, а когда скорость максимальна, равна нулю действующая сила.
§7. Аналогии при изучении постулатов Бора.
Формирование и развитие у учащихся модельных представлений атома как структурной единицы вещества имеет важное научно – познавательное и мировоззренческое значение.
В курсе физики 7 класса учащиеся узнают об атомах как о мельчайших частицах вещества, из которых состоят более крупные образования – молекулы.
В курсе электричества 8 класса картина меняется: модель атома становится доминирующей. Здесь у учащихся формируется представление об атоме как о сложной динамической системе, состоящей из сконцентрированной в небольшом объеме положительной части – ядра и электронов, движущихся относительно ядра и несущих отрицательный заряд.
Планетарную модель атома доказывают опытом Резерфорда по рассеянию α – частиц металлическими пластинками. Известно несколько моделей этого опыта. Например, при описании опыта Резерфорда использована аналогия с зондированием кипы сена с помощью пуль. При этом по траектории пуль можно определить, где спрятаны куски металла.
При рассказе о ядерной модели атома применяют аналогию с солнечной системой. Здесь важны образные сравнения – аналогии: масса ядра атома в несколько тысяч раз больше массы электрона (например, масса ядра атома водорода больше массы электрона в 2000 раз), так же как и масса Солнца больше массы отдельной планеты в несколько сотен тысяч раз (например, больше массы Земли в 333000 раз). Другое сравнение : диаметр ядра примерно в 10000 раз меньше диаметра атома; аналогично, диаметр Солнца (13000 км) во много миллионов раз меньше размеров солнечной системы.
Эти сравнения помогают учащимся создать представление о масштабах ядерной модели атома. Но движение электронов относительно ядра более сложнее, чем орбитальное движение планет и оно подчиняется другим законам. Ядерную модель атома затем используют для объяснения электризации тел, явления электропроводности, при изучении электрического тока в металлах и электролитах. О дальнейшем развитии планетарной модели атома рассказывают после изучения фотоэффекта.
Для объяснения закономерностей фотоэффекта вводят представление о дискретности светового излучения, а также понятие о фотоне как элементарной частице света с энергией Е=hν. Отсюда возникает вопрос: является ли дискретность энергетических состояний свойством, характерным лишь для излучающих твердых тел, или же эта дискретность присуща любым атомным системам?
Подобные рассуждения привели в 1913 году И. Бора к предположению о неприменимости максвелловской электродинамики к электронам, движущимся в атомах. В основу своей теории Н. Бор положил следующие постулаты:
1) в атоме происходят движения электронов по некоторым стационарным круговым орбитам без излучения;
2) стационарными будут те орбиты, для которых момент количества движения электрона mvR равен целому кратному величины h/2π, то есть
mvnRn=nh/2π , где n=1, 2, 3….
3) излучение и поглощение света атомами происходит при переходе электронов с одних стационарных орбит на другие.
Планетарная модель атома в теории Бора “модернизирована”, то есть электроны могут перескакивать с орбиты на орбиту, когда атом переходит из одного стационарного состояния в другое.
Так, при изложении вопроса об излучении света атомом существует аналогия с реальным макропроцессом—вылетом стрелы из лука.
Оба процесса возможны только в том случае, если участвующие в них объекты (атом, лук) находятся в возбужденном состоянии (в последнем случае под «возбуждением» понимается натяжение тетивы). Тетива и атом в конечном счете возвращаются в невозбужденное состояние (ему соответствует наименьшее из возможных значение энергии); при этом соблюдается закон сохранения энергии (потенциальная энергия упруго деформированной тетивы переходит в кинетическую энергию стрелы, а энергия возбуждения атома«уносится» фотоном: Е2-Е1=hν.
Однако между этими явлениями есть различие:
1) при натяжении тетивы ей может быть сообщена любая энергия, т. е. ее энергия может изменяться непрерывно; для возбуждения атома ему нужно сообщить определенную порцию (квант) энергии, соответствующую разности уровней энергии, между которыми осуществляется «переход» электрона в рамках модели Резерфорда—Бора;
2) возвращаясь в «невозбужденное» состояние, тетива «проходит» все промежуточные состояния (значения энергии),, таких состояний, очевидно, бесчисленное множество; электрон же в атоме переходит из любого возбужденного состояния в нормальное либо одним, либо несколькими последовательными скачками, минуя промежуточные значения энергии;
3) стрела, символизирующая световой квант, существовала до возбуждения тетивы и до вылета покоилась относительно лука, при вылете она постепенно набирала скорость от нуля до какого-то максимального значения; фотон “рождается” лишь благодаря переходу атома из состояния с большей энергией в состояние с меньшей энергией, т.е. переходу электрона на более низкую орбиту; покоящегося же (относительно любой системы отчета) фотон не существует: фотон сразу приобретает скорость света.
Постулаты Бора дают возможность вычислить полную энергию атома исходя из уравнений:
mvR=nh/2π (1)
![]() (2)
(2)
![]()
![]() (3)
(3)
V=nh/2πmR; n2h2/4π2mR3=Ze2/R2
R=n2h2/Ze24π2m
E=-![]() (4) где n =1, 2, 3…
(4) где n =1, 2, 3…
Полную энергию атома при определенном стационарном состояии называют энергетическим уровнем. Вычисляя значения E при n=1, E при n=2 и т. д., получаем ряд значений энергии:
Е1=-13,53 эВ; Е2=-3,4 эВ; Е3=-1,5 эВ; Е4=-0,8 эВ и т.п.
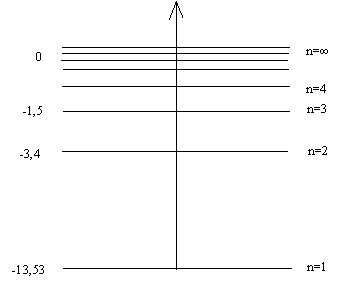
При n=∞ Е∞=0.
После вычислений строим график (рис.5.):
Рис.5.
Ось энергии в этом графике берут вертикальной, за начало отсчета выбирают энергию атома, когда его электрон удален в бесконечность – это нулевой уровень энергии атома. Так как энергия атома орбитальна, то все последующие значения энергии будут ниже нулевого уровня. Минимум энергии (E1=-13,53эВ) атома соответствует невозбужденному его состоянию, когда электрон находится на наиболее близкой к ядру орбите. Выбирают масштаб таким образом, чтобы потом легко было разделить отрезок, соответствующий расстоянию между уровнями E∞ и E1 на 4, 9, 16 и т. д., равных частей. Построенное таким образом изображение значений энергии атома в различных его состояниях называют энергетической моделью атома.
