Строение, свойства и биологическая роль биотина и тиамина
R1—COO- + R2H![]() R1H + R2— COO-
R1H + R2— COO-
Поскольку все приведенные реакции являются обратимыми, возможен обратимый биосинтез АТФ. Во всех этих случаях имеет место включение С02 в реактивное α-подожение ацил-КоА или винилгомоло-гичное ему положение (при карбо^силировании β-метилкротонил-КоА).
К началу 60-х год5В были выделены и изучены карбоксилазы, осуществляющие указанные превращения —В 1960 г. установлено участие биотина в реакции транскарбоксилирования при исследовании синтеза пропионовои кислоты
СНз—СН—СО~S—КоА + СНз—СО—СООН ![]()
СООН
![]() СНз-СНа—СО~S-КоА + НООС-СН2—СО—СООН
СНз-СНа—СО~S-КоА + НООС-СН2—СО—СООН
Биотиновые ферменты представляют собой олигомеры с большим молекулярным весом (порядка 700000) и, как правило, содержат 4 моля связанного биотина на 1 моль фермента, поэтому кажется вероятным, что они состоят из 4 субъединиц с молекулярным весом 175000, каждая из которых содержит одну молекулу биотина.
В работах Lynen (1964) расшифрован механизм участия биотина в реакциях карбексилирования. Установлено, что реакции карбоксилирования являются двухстадийными. Первая стадия сводится к образованию «активной С02» в форме С02~биотинфермента:
АТФ + Н С0-2+ биотинфермент ![]() АДФ + Фнеорг. + С02~биотинфермент.
АДФ + Фнеорг. + С02~биотинфермент.
Вторая стадия заключается в переносе «активной С02» на акцептор:
С02~биотинфермент + R2H ![]() биотинфермент + R2— С00-
биотинфермент + R2— С00-
Аналогичный двух стадийный механизм предложен и для реакций транскарбоксилирования:
R1 —С00- + биотинфермент ![]() С02 ~биотинфермент R2H;
С02 ~биотинфермент R2H;
С02~биотинфермент + R2H![]() R2— С00- + биотинфермент.
R2— С00- + биотинфермент.
После установления существования «активной С02» в виде С02~биотинфермента установлен характер связи между С02 и биотином. Этому способствовало открытие того факта, что β-метилкротонил-КоА-карбоксилаза способна карбоксилировать свободный биотин, переводя его в карбоксибиотин. В дальнейшем меченый карбоксибиотип был выделен в опытах с С14-бикарбонатом и идентифицирован как Г-М-карбоксибиотин. Его структура была подтверждена химическим синтезом. К атому времени уже было известно, что в биотиновых ферментах карбоксильная группа биотина соединена с ε-NH2-группой лизина ферментного белка ковалентной связью. На основании этих данных предложена структура С02~биотинфермента.
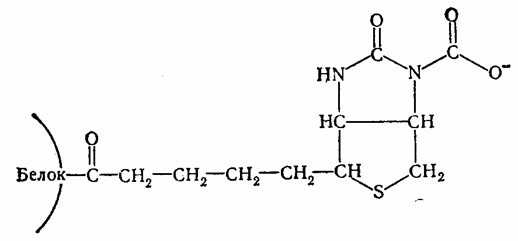
Эта структура получила ряд экспериментальных подтверждений и в настоящее время является общепринятой для всех биотиновых ферментов. Реакционная способность углекислоты, связанной с биотином, находит выражение в энергетических взаимоотношениях. Величина свободной энергии распада С02~биотинфермента равна 4,74 ккал/моль, что дает основание причислить С02~биотинфермента к «богатым энергией» соединениям.
Исключительно большой интерес представляет совершенно неизученная проблема регуляции активности биотинсодержащих ферментов и организме. В этой связи особенно важны исследования по биосинтезу молекулы биотина и образованию холоферментов из биотина и соответствующего ферментного белка. Данные по первому вопросу изложены в разделе «Биосинтез». Что касается образования холофермента, то можно считать установленным, что во всех биотиновых ферментах био-тнн связан с ε-аминогруппой лизина. Этот способ связи экспериментально доказан почти для всех карбоксилаз и метилмалонил-КоА-оксалоаце-таттранскарбоксилазы. Недостаточные по биотину клетки Propionibacterium shcemanii содержат апофермент и специфическую синтетазу, которая катализирует при использовании АТФ соединение биотина с апоферментом, приводящее к образованию активного холофермента траискарбокснлазы. Необходимыми кофакторами этой реакции являются АТФ и Mg2+. При использовании очищенных ферментов удалось доказать, что образование холотранскарбоксилазы происходит в два этапа, причем промежуточным соединением является биотиниладенилат (R-CO-5'-AMФ):
Mg2+
I. АТФ + R— С02Н + синтетаза![]() R-СО-5’- АМФ - синтетаза + пирофосфат
R-СО-5’- АМФ - синтетаза + пирофосфат
(биотин
![]() II. R-СО-5’- АМФ - синтетаза + Н2М-фермент R-CO-NH-фермент +
II. R-СО-5’- АМФ - синтетаза + Н2М-фермент R-CO-NH-фермент +
+5’-AMФ+cинтeтaзa.
Синтетический биотиниладенилат обладает способностью заменить смесь АТФ, MgCl и биотина при синтезе холофермента (Lynen, 1964). Позже было установлено, что образование других холоферментов протекает аналогичным образом. Все известные ферментативные реакции, для которых установлено участие биотина в качестве кофермента, являются процессами переноса углекислоты. По-видимому, в обратимом присоединении и отдаче СО; и состоит исключительная функция этого витамина в обмене веществ. Однако при биотиновой недостаточности нарушаются очень многие реакции обмена в интактном организме. Так, - биотин вовлечен в биосинтез белков, дезаминирование аспартата, серина и треонина у бактерий, обмен триптофана, жиров и углеводов, синтез пуринов, образование мочевины у животных и др. Природа участия биотина во многих из этих реакций остается неясной. Все перечисленные процессы имеют одну общую черту: при изучении in vitro они не тормозятся авидином. На основании этих данных считается, что биотин оказывает.непрямое действие на указанные превращения, которые катализируются ферментами, не содержащими этого витамина.
Ввиду чрезвычайной важности нeкоторых из этих реакций для жизне-деятельности организма необходимо рассмотреть их. Рядом авторов отмечено, что при недостаточности биотина в рационе крыс снижается включение в белок меченых аминокислот. Так, включение (С14-метионина, С14-лейцина и С14-лизина в тканевые белки снижается на 20—40% причем недостаточность биотина влияет на стадию образования амино-ацил-транспортной РНК. Препараты тРНК из печени нормальных крыс включают значительно больше меченых аминокислот, чем препараты печени авитаминозных животных (Dakshinainurti, Misty, 1964). Еще ранее было установлено, что у авитаминозных животных нарушается синтез амилазы в поджелудочной железе и сывороточного альбумина в печени, причем однократное введение 100 мкг биотина восстанавливает способность тканей к синтезу указанных белков. Добавление in vitro α-кетоглутарата и фумарата также восстанавливает образование амилазы и сывороточного альбумина (А. А. Познанская, 1957).
Эти данные показали, что биотин не принимает прямого участия в синтезе белка de novo, а его влияние на этот процесс, по-видимому, определяется вовлечением биотина в синтез субстратов трикарбонового цикла. Такое предположение нашло подтверждение в опытах на цыплятах: скармливание сукцината авитаминозным птицам восстанавливало до нормы включение аминокислот в тканевые белки и РНК. Так как образование С4-дикарбоновых кислот в организме животных протекает через фиксацию СО2, осуществляемую биотиновыми ферментами, то становятся ясными причины нарушения синтеза белка при биотиновой недостаточности. В организме авитаминозных цыплят значительно снижены скорость окисления глюкозы до СО2 и включение ее в гликоген печени. Имеются указания на снижение глюкокиназной активности при недостаточности биотина, хотя витамин не был обнаружен в препаратах кристаллического фермента. Возможно, что участие биотина в обмене. углеводов является непрямым. В результате нарушения утилизации глюкозы в организме животных при исключении биотина из корма нарушается превращение D-глюкозы в L-аскорбиновую кислоту.
