Выбор катализатора амидирования и изучение в его присутствии превращения м-толуиловой кислоты в N,N-диэтил-м-толуамид
![]()
В зависимости от типа катализатора, используемого при реакции, аминолиз протекает по механизмам AAC2 или BAC2.
Естественно, лактоны и фталиды аналогичным образом превращаются в имиды без раскрытия кольца [20].
В свою очередь действие на ангидриды карбоновых кислот амидирующих агентов (в том числе мочевины и уретанов) протекает обычно без катализаторов
![]()
В случае менее реакционноспособных реагентов (например, дифенил-амина или 2,4-динитроанилина) ацетилирование уксусным ангидридом проводят в присутствии кислотного катализатора [14].
Однако синтезы на основе ангидридов более широко применяются для получения имидов, чем амидов, при этом циклические ангидриды могут давать только имиды, кислые имиды или диимиды в зависимости от реагента и условий эксперимента [21].
Упомянутая несколько выше мочевина может реагировать напрямую с карбоновыми кислотами (синтез по Шербулье [16]).
![]()
Следующий метод - один из наиболее широко применяемых способов получения амидов, по которому выходы последних обычно составляют 80-90%. Отрицательным свойством данной реакции является потеря одного эквивалента амина на связывание высвобождающегося хлористого водорода
![]()
Реакция сильно экзотермична [22], поэтому зачастую ее проводят в растворителях, например, в дихлорэтане [23], четыреххлористом углероде [24], хлороформе [25], толуоле [26] и т.п. Количественному протеканию конденсации способствует присутствие водного раствора гидроксида натрия [27]. Механизм ацилирования, как правило, соответствует типу SN2 [28], а реакционная способность агентов симбатна ряду кислотностей соответствующих кислот и убывает в последовательности RCOHal >(RCO)2O ≈ RCOOR > RCONR2 > RCOR. Кроме того, скорость реакция увеличивается с ростом нуклеофильности амина и может осуществляться основной и даже кислотный автокатализ [29].
Целесообразно упомянуть и другие, представляющие синтетический интерес, ацилирующие агенты: кетены, диктены, кетонитрилы, карбамоилхлориды [14]. В последнем случае в реакцию могут вступать арены, но в присутствии кислот Льюиса (реакция Гаттермана-Хопфа [16]).
![]()
Представляет интерес путь через нитрилы - вполне доступный класс соединений [16]:
![]()
Реакцию проводят с осторожностью, т.к. первичный амид часто подвергается дальнейшему гидролизу до соответствующей карбоновой кислоты и аммиака. Кислоты и щелочи сильно ускоряют реакцию. При кислотном катализе процесс протекает за счет атаки воды на протонированную форму нитрила, в то время как при основном катализе ион гидроксила взаимодействует со свободным нитрилом. В последнем случае в качестве реагента применяют водный раствор NaOH, содержащий 6-12% перекиси водорода, т.к. гидропероксид-анион в несколько тысяч раз активнее гидроксид-иона [14]. Ароматические нитрилы дают почти количественные выходы, хотя для о-замещенных нитрилов необходимо применять пергидроль.
Гидролиз до амидов в безводных условиях при комнатной температуре можно проводить в присутствии метилсульфинил метида натрия с выходом 75-95% [30]. Альтернативный вариант - это реакция Риттера [31], когда нитрил реагирует с алкенами или спиртами [32]:
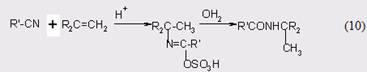
Механизмы реакций превращения нитрилов в амиды достаточно подробно изучены [33], но в данном случае нет необходимости подвергать их анализу.
Таким образом, краткий обзор общих методов получения амидов позволяет сделать некоторые выводы. Все основные методы получения амидов, как правило, могут быть применимы как для алифатических, так и для ароматических членов гомологических рядов. Во всех случаях кроме тех, где реакции принципиально могут протекать чисто термически, процессы катализируют кислотные или основные катализаторы; применяемые гетерогенные контакты также содержат кислотные центры, но преимущественно Льюисовского типа.
1.2 Методы получения N, N-диэтил-м-толуамида
Как указано во введении, до настоящего времени ДЭТА производят по классическому методу, который основан на окислении м-ксилола в м-то-луиловую кислоту, превращении последней в хлорангидрид и последующем ацилировании им N,N-диэтиламина [2].
Из методов модифицирования указанного варианта следует упомянуть работы по совместному получению бензилхлоридов и амидов ароматических кислот [34], когда обрабатывают полностью замещенные бензиламины общей формулы RR’NCH2Ar (R, R’- алкил) хлорангидридом ароматической кислоты ArCOCl, получая при этом ArCONRR’ и ArCH2Cl с выходом 83,5 и 80% соответственно. Преимуществом данного способа является минимальное образование сточных вод и экологически опасных выбросов и получение двух целевых продуктов одновременно. Однако не устранены отрицательные факторы: многостадийность, периодичность и использование хлорпроизводных (фосгена или хлористого тионила).
К новым методам получения ДЭТА относятся следующие: амидирование эфиров м-толуиловой кислоты; совместное с гидролизом амидирование нитрила м-толуиловой кислоты; прямое амидирование м-толуиловой кислоты диэтиламином в жидкой или газообразной фазе.
Амидирование эфиров м-толуиловой кислоты подразумевает предварительную стадию получения эфиров этерификацией кислоты спиртами в присутствии серной, фосфорной или соляной кислот с одновременной отгонкой азеотропа спирт-вода. После нейтрализация кислоты и отмывки полученный катализат подвергают вакуумной ректификации. Таким образом, по сравнению с классическим методом получения ДЭТА, включающим стадию синтеза хлорангидрида м-толуиловой кислоты, синтез алкилового эфира имеет неоспоримое преимущество, но вопросы экологии и очистки сточных вод остаются. Само амидирование диэтиламином проводят в присутствии водоотнимающих катализаторов [35], а в качестве сырья используют метиловый эфир м-толуиловой кислоты в соотношении с диэтиламином 1:3-7 мольн., которые нагревают в автоклаве при температуре 270-280°С в течение 2-8 ч. Избыточное количество амина отгоняют, соль ароматической кислоты с диэтиламином разрушают 30%-ной серной кислотой и после стадии отмывки и нейтрализации извлекают целевой продукт экстракцией толуолом (выход 55%). В тех случаях, когда используют нитрил м-толуиловой кислоты [36]. ДЭТА получают с выходом более 90%. Процесс реализуют в автоклаве при температуре 230°С и мольном соотношении реагентов нитрил: алкиламин: вода равном 1:1-1,5:1-2, времени реакции 2-12 ч. В качестве катализаторов используют перекиси, неорганические и органические кислоты и их соли, например, ацетат свинца. В катализатах обнаружены также N-этилтолуамид и м-толуамид при конверсии нитрила 90%, однако процесс многостадиен и не обеспечен сырьевой базой. Наибольшее внимание исследователей посвящено разработке метода синтеза ДЭТА прямым амидированием м-толуиловой кислоты диэтиламином. Действительно, метод прямого амидирования привлекателен уже тем, что это одностадийный процесс, который может быть осуществлен как в периодическом, так и в непрерывном вариантах. Реакция протекает при повышенных температурах в присутствия гомогенного или гетерогенного катализаторов.
