Выбор катализатора амидирования и изучение в его присутствии превращения м-толуиловой кислоты в N,N-диэтил-м-толуамид
ΔНсгор= - (204,2n + 44,4m + Σх),
где n - число атомов кислорода, необходимое для полного сгорания вещества; m - число молей образующейся воды; х - поправка (термическая характеристика), постоянная в пределах гомологического ряда.
Термическая характеристика (х) - это фактически инкремент численных значений группы атомов или типа связи. Так, например, для МТК х = 100,4 кДж/моль [54]. Таким образом, выполненный термодинамический расчет показал возможность количественного превращения м-толуиловой кислоты в м-ДЭТА и позволил определить область режимов проведения реакции, соответствующих достижению поставленной цели.
3.2 Испытание традиционных и модифицированных катализаторов амидирования алифатических кислот
Выявив термодинамически наиболее благоприятные условия проведениия исследуемой реакции, мы испытали некоторые традиционные (γ-Al2O3, SiO2) [55] и модифицированные (Zn/SiO2, Sn/SiO2 – силикагель типа МСК [56]) катализаторы амидирования, используемые в промышленных процессах получения алифатических амидов.
Общая тенденция роста конверсии и уменьшения селективности процесса при увеличении температуры реакции сохраняется для всех катализаторов (рис. 3.1, 3.2). Однако при использования немодифицированного SiO2 типа МСК скорость реакции с повышением температуры увеличивается в большей степени, чем для Al2O3, поэтому силикагель был выбран в качестве носителя при приготовлении систем Sn/SiO2 и Zn/SiO2. Тем не менее модифицированные системы не показали каких-либо аномальных свойств.
Полученные данные (табл. 3.2) свидетельствуют о том, что применение, например, γ – Al2O3 позволяет достичь 42-59%-ной конверсии МТК при 260-3200С (31-34%-ный выход ДЭТА - идентифицирован методом ЯМР, см. гл. 1). Однако лучшие результаты получены на катализаторе Sn/SiO2 (1 мас.%): в этом случае конверсия МТК в том же температурном диапазоне достигает 78-90% (выход ДЭТА 71%) [57].
Таким образом, даже когда удается достичь высокой конверсии субстрата (90%), выход ДЭТА достаточно низкий (71%) из-за невысокой селективности процесса. Другим, безусловно более существенным отрицательным свойством указанных катализаторов является их низкая стабильность работы - 10-12 ч.
Также обращает на себя внимание факт, что активность испытанных катализаторов не связана с их удельной поверхностью, которая находятся в пределах 230-560 м2/г. Это может свидетельствовать о том, что амидирование протекает поверхностно. По-видимому, это связано с большим объемом реагирующих молекул, который либо соизмерим с объемом пор катализаторов, либо превышает его. Кроме того, следует иметь в виду, что при высоких температурах увеличивается не только колебательный размер молекул (их пульсация - критический объем), но и снижается вероятность вхождения реактантов в поры контакта.
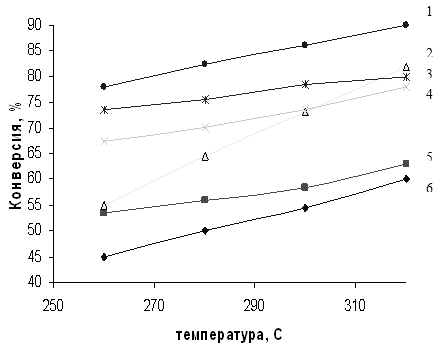
Рис. 3.1 Зависимость конверсии МТК от температуры реакции амидирования на различных катализаторах.
1 – 1% Sn/SiO2, 2 – SiO2, 3 – 5% Sn/SiO2, 4 – 5% Zn/SiO2, 5 – 1% Zn/SiO2, 6 – Al2O3.
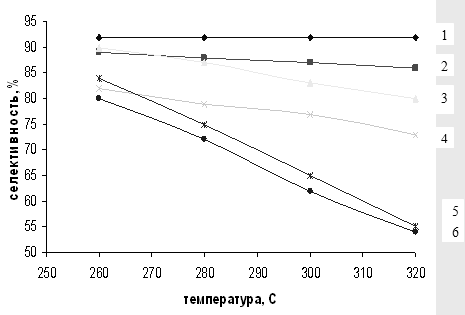
Рис. 3.2 Зависимость селективности образования м-ДЭТА от температуры на различных катализаторах.
1 – 1% Sn/SiO2, 2 – SiO2, 3 – 5% Sn/SiO2, 4 – 5% Zn/SiO2, 5 – 1% Zn/SiO2, 6 – Al2O3.
Таблица 3.2 Амидирование м-толуиловой кислоты диэтиламином (1:5 мольн.) на различных гетерогенных катализаторах при объемной нагрузке по сырью 0,2 ч-1
|
Катализатор (удельная поверхность, м2/г) |
Температура, 0С |
Конверсия МТК, % |
Селективность образования ДЭТА, % |
|
Фторированная γ- Al2O3 (230) |
260 280 300 320 |
42,1 47,3 54,8 59,4 |
80,8 68,1 59,8 52,5 |
|
SiO2 типа МСК (560) |
260 280 300 320 |
55,2 61,5 74,3 82,9 |
92,6 92,0 91,8 91,0 |
|
1 масс.% Zn на SiO2 (555) |
260 280 300 320 |
53,2 55,0 58,7 66,4 |
84,4 72,3 63,1 53,0 |
|
5 масс.% Zn на SiO2 (552) |
260 280 300 320 |
66,7 70,6 73,4 76,6 |
83,4 79,8 74,3 70,1 |
|
1 масс.% Sn на SiO2 (556) |
260 280 300 320 |
78,6 87,8 87,9 90,0 |
90,4 88,0 82,8 79,2 |
|
5 масс.% Sn на SiO2 (552) |
260 280 300 320 |
73,8 75,5 77,6 80,9 |
89,3 87,1 87,0 84,6 |
В свете изложенного в данном разделе материала дальнейшие исследования были ориентированы на поиск приемов, способствующих более быстрому протеканию основной реакции (попытка увеличить селективность процесса) с одновременным рассмотрением при необходимости вопроса о стабилизации работы контакта.
Решение такой задачи, по нашему мнению, могло быть осуществлено в ходе или после изучения механистических аспектов данной проблемы.
3.3 Механизм амидирования как метод предсказания путей интенсификации реакции
Данные, представленные в разделе 3.2, свидетельствуют о том, что гетерогенные катализаторы, традиционно используемые даже в промышленных масштабах при амидировании алифатических кислот, оказались нестабильными и быстро теряли селективность при получении ароматических амидов. Причина неудовлетворительной работы оксидов алюминия и кремния в основном обусловлена быстрым закоксовыванием поверхности, что, по нашему мнению, связано с наличием на Al2O3 преимущественно льюисовских (слабых) кислотных центров. Повышение силы последних на фторированном оксиде алюминия больше сказывается на увеличении скорости реакции, чем на повышении стабильности катализатора, которая могла быть увеличена не более чем на 2-3 ч. Усиление каталитических свойств оксида кремния, как и незначительное, но тем не менее имевшее место пролонгирование его эффективной работы, по-видимому, обусловлено присутствием наряду с льюисовскими также и бренстедовских кислотных центров. Хорошо известно, что амидирование ускоряется в присутствии кислотных или щелочных агентов, т.е. имеет место кислотный или основной катализ. В последнем случае можно рассчитывать, что взаимодействие МТК с диэтиламином, по крайней мере в незначительной степени, должно наблюдаться in vitro. Тем не менее смесь двух реагентов не претерпевала видимых изменений даже при повышенных температурах в течение нескольких дней, т.е. не наблюдался общий основной катализ. Последнее, в частности, подтверждается тем, что порядок реакции по диэтиламину, когда его избыток не превышает 1,5 мольн. по отношению к МТК, составляет единицу. В тех случаях, когда реакция может катализироваться самим реагентом, порядок реакции по нему, как правило, равен 2, и в состав переходного состояния должна входить вторая молекула амина. Изложенное побудило нас ввести в реакцию "независимый" основной катализатор, а именно – Al2O3, обработанный гидроксидами щелочных и щелочноземельных металлов (Li, Na, K и Ba). Такой контакт безусловно катализировал реакцию, но продолжительность его активной работы определялась временем увода щелочи толуиловой кислотой (во всяком случае в катализатах присутствовали толуилаты соответствующих металлов). Любопытен факт отсутствия сравнительной активности у различных щелочных агентов, т.е. сила щелочи, нанесенной на Al2O3, не имела принципиального значения. Однако при использовании гидроксида бария первоначальная активность контакта (первые 2-3 часа работы) была ниже, чем наблюдалось нами для других случаев. Этот эффект, скорее всего, можно приписать тормозящему действию катиона Ba2+. Другим отрицательным свойством основных катализаторов являлось их более быстрое, чем в случае необработанного Al2O3, закоксовывание. Теперь рассмотрим вариант кислотно-катализируемого амидирования МТК. В данном случае оксид алюминия пропитывали растворами и ортофосфорной, соляной, иодноватой, борной или хлорной кислот. Обнаружено, что в общем случае, чем больше сила кислоты, тем активнее катализатор, однако для очень сильных кислот (HCl, HJO3, HClO4) эта разница практически отсутствует. Однако скорость реакции зависела от концентрации нанесенной на Al2O3 сильной кислоты, причем характер зависимости экстремальный (ранее подобное явление было отмечено для гидролиза амидов в водно-кислотных растворах). Такая картина является обычной для механизма AAC2 в концентрированных водных растворах кислот. Этот факт, с учетом выявленной нами, зависимости скорости реакции от концентраций обеих реагирующих молекул и протона, позволяет с большей уверенностью говорить о том, что и в случае гетерогенно-катализируемой реакции общий вид механизма не может отличаться от типа А 2. Вопрос о том, ацильный или алкильный маршрут включает данный механизм, не имеет принципиального значения для решаемой нами задачи, и в общем виде он может быть представлен следующим образом (рассмотрение стадий протонирования амина или солеобразования вносит дополнительные сложности в описание механизма реакции и их обычно опускают. В общем-то, предполагают, что активные частицы кинетически неразличимы):
