Равновесные и поляризационные диаграммы потенциал-pH
Для некоторого процесса ![]() энергию Гиббса можно рассчитать как:
энергию Гиббса можно рассчитать как:
![]() (2.1)
(2.1)
Здесь ![]() - это минимальное значение давления кислорода в газовой фазе, при котором в среде начнется окисление. Соответственно, чем меньше
- это минимальное значение давления кислорода в газовой фазе, при котором в среде начнется окисление. Соответственно, чем меньше ![]() , тем легче окисление Me.
, тем легче окисление Me.
Исходя из уравнения (2.1) найдем значения ![]() для реакций (1), (3) и (4):
для реакций (1), (3) и (4):
![]() = 4,57·10-46 атм.
= 4,57·10-46 атм.
![]() = 1,18·10-38 атм.
= 1,18·10-38 атм.
![]() = 7,28·10-6 атм.
= 7,28·10-6 атм.
В системе может протекать выделение кислорода:
(6) O2 + 4ē + 4H+ = 2H2O ![]() = - 470 461 Дж/моль
= - 470 461 Дж/моль
Фазовые переходы Cu в данной системе описываются следующими уравнениями:
(I) Cu2+ + 2ē = Cu0 φ = 0,337 B ![]() = - 65 031 Дж/моль
= - 65 031 Дж/моль
(II) Cu2O + 2H+ + 2ē = 2Cu0 + H2O φ = ? ![]() = - 84 682 Дж/моль
= - 84 682 Дж/моль
(III) 2Cu2+ + H2O + 2ē = Cu2O + 2H+ φ = ?
(IV) 2CuO + 2H+ + 2ē = Cu2O + H2O φ = ?
(V) CuO + 2H+ = Cu2+ + H2O φ = ?
(VI) Cu2O3 + 6H+ + 2ē = 3H2O + 2Cu2+ φ = ?
(VII) Cu2O3 + 2H+ + 2ē = 2CuO + H2O φ = ?
По закону Гесса для реакций (III) – (VII):
![]() = 2·
= 2·![]() -
- ![]() = - 45 380 Дж/моль
= - 45 380 Дж/моль
![]() =
= ![]() + 0,5·
+ 0,5·![]() - 2·
- 2·![]() = -127 049 Дж/моль
= -127 049 Дж/моль
![]() = 0,5·
= 0,5·![]() -
- ![]() -
- ![]() = - 40 835 Дж/моль
= - 40 835 Дж/моль
![]() = 1,5·
= 1,5·![]() - 2·
- 2·![]() -
- ![]() = - 302 238 Дж/моль
= - 302 238 Дж/моль
![]() = 0,5·
= 0,5·![]() + 2·
+ 2·![]() -
- ![]() = - 220 569 Дж/моль
= - 220 569 Дж/моль
В общем виде электродный процесс можно записать как:
![]()
По основному закону термодинамики электрохимических систем:
![]() (2.2)
(2.2)
Свободная энергия Гиббса определяется по следующей формуле:
Δ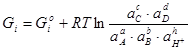 (2.3)
(2.3)
Подставляя (2.3) в (2.4), переходя от натуральных логарифмов к десятичным и с учетом того, что ![]() , получаем:
, получаем:
![]() (2.4)
(2.4)
Для линий чисто химических равновесий энергия Гиббса вычисляется по формуле:
![]() (2.5)
(2.5)
Подставляя уравнение (2.5) в (2.2) и проводя соответствующие преобразования, получаем:
![]() (2.6)
(2.6)
Исходя из приведенных выше формул, ведется расчет линий зависимости φ от pH для реакций (I) – (VII):
|
№ линии |
Электродная реакция |
Равновесный потенциал, В (н. в. э.) или рН раствора |
|
I |
|
|
|
II |
|
|
|
III |
|
|
|
IV |
|
|
|
V |
|
|
|
VI |
|
|
|
VII |
|
|
Для линий I, III, V и VI величину активности ионов Cu2+ можно варьировать. В данном случае берутся значения ![]() = 0, 10-2, 10-4 и 10-6. Тогда:
= 0, 10-2, 10-4 и 10-6. Тогда:
Для I:
φ1 = 0,337 В
φ2 = 0,278 В
φ3 = 0,219 В
φ4 = 0,160 В
Для III:
φ1 = 0,235 + 0,0591pH
φ2 = 0,117 + 0,0591pH
φ3 = - 0,001 + 0,0591pH
φ4 = - 0,120 + 0,0591pH
Для V:
pH1 = 3,58
pH2 = 4,58
pH3 = 5,58
pH4 = 6,58
Для VI:
φ1 = 1,566 – 0,1773pH
φ2 = 1,684 – 0,1773pH
φ3 = 1,802 – 0,1773pH
φ4 = 1,921 – 0,1773pH
