Равновесные и поляризационные диаграммы потенциал-pH
![]()
![]() (1.5.1)
(1.5.1)
где ![]() - энергия активации.
- энергия активации.
Если мы найдем связь между энергией активации ![]() или
или ![]() и сдвигом потенциала от равновесного значения
и сдвигом потенциала от равновесного значения ![]() , то с помощью уравнения (1.5.1) можно определить зависимость между скоростями реакций
, то с помощью уравнения (1.5.1) можно определить зависимость между скоростями реакций ![]() или
или ![]() и
и ![]() .
.
Величина работы А перехода 1 г-иона металла в раствор измеряется разностью потенциальной энергии катионов на поверхности электрода и сольватированных катионов в плотной части двойного слоя, находящихся на расстоянии ![]() от поверхности электрода. В плотной части двойного слоя осуществляется скачок потенциала
от поверхности электрода. В плотной части двойного слоя осуществляется скачок потенциала ![]() . Выражая величину А в электрических единицах, получим
. Выражая величину А в электрических единицах, получим
![]() (1.5.2)
(1.5.2)
Величина ![]() зависит от природы металла и концентрации ионов в двойном слое. Очевидно, что изменить потенциал металла можно, изменив строение двойного слоя, в частности, увеличив или уменьшив концентрацию ионов у поверхности электрода. Этого можно в известной мере добиться просто изменением концентрации раствора. Однако в данном случае такой вариант не подходит, так как новой концентрации будет отвечать новый равновесный потенциал, и реакции окисления протекать не будет. Также потенциал можно изменить и за счет приложения ЭДС от внешнего источника, причем через поверхность электрода протекает ток. Для этого должен быть использован вспомогательный электрод, и от какого-либо источника ЭДС между электродами должен быть пропущен ток. В зависимости от направления тока потенциал рассматриваемого электрода может быть сдвинут в сторону более положительных или более отрицательных значений от равновесного [5].
зависит от природы металла и концентрации ионов в двойном слое. Очевидно, что изменить потенциал металла можно, изменив строение двойного слоя, в частности, увеличив или уменьшив концентрацию ионов у поверхности электрода. Этого можно в известной мере добиться просто изменением концентрации раствора. Однако в данном случае такой вариант не подходит, так как новой концентрации будет отвечать новый равновесный потенциал, и реакции окисления протекать не будет. Также потенциал можно изменить и за счет приложения ЭДС от внешнего источника, причем через поверхность электрода протекает ток. Для этого должен быть использован вспомогательный электрод, и от какого-либо источника ЭДС между электродами должен быть пропущен ток. В зависимости от направления тока потенциал рассматриваемого электрода может быть сдвинут в сторону более положительных или более отрицательных значений от равновесного [5].
Измеряемый катодный ток определяется разность токов прямого и обратного направления:
![]() (1.5.3)
(1.5.3)
Поскольку ток обмена является частным значением токов ![]() или
или ![]() при
при ![]() , уравнение (1.5.3) можно преобразовать к виду
, уравнение (1.5.3) можно преобразовать к виду
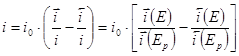 (1.5.4)
(1.5.4)
Так как функциональные зависимости ![]() и
и ![]() имеют вид
имеют вид ![]() и
и ![]() , то уравнение (1.5.4) можно записать в форме
, то уравнение (1.5.4) можно записать в форме
![]() (1.5.5)
(1.5.5)
Где ![]() - катодное перенапряжение стадии разряда – ионизации.
- катодное перенапряжение стадии разряда – ионизации.
Уравнение (1.5.5) в сочетании с выражением для тока обмена является общим уравнением поляризационной кривой для одностадийной реакции разряда – ионизации. Проанализируем уравнение (1.5.5), предполагая, что ![]() , а
, а ![]() - потенциал достаточно мал для того, чтобы можно было пренебречь зависимостью
- потенциал достаточно мал для того, чтобы можно было пренебречь зависимостью ![]() от
от ![]() . При выполнении условия, что
. При выполнении условия, что ![]() намного превышает значение
намного превышает значение ![]() можно пренебречь второй экспонентой в уравнении (1.5.5), так что
можно пренебречь второй экспонентой в уравнении (1.5.5), так что
![]() (1.5.6)
(1.5.6)
или
![]() (1.5.7)
(1.5.7)
Вводя обозначения ![]() и
и ![]() , уравнение (1.5.7) можно переписать в виде
, уравнение (1.5.7) можно переписать в виде
![]() (1.5.8)
(1.5.8)
Уравнение (1.5.8) называют уравнением Тафеля. По наклону тафелевской прямой легко найти коэффициент переноса ![]() , а затем, учитывая связь константы
, а затем, учитывая связь константы ![]() с
с ![]() , определить ток обмена.
, определить ток обмена.
При больших анодных перенапряжениях, когда ![]() и намного превышает значение
и намного превышает значение ![]() , из уравнения (1.5.5) следует
, из уравнения (1.5.5) следует
![]() (1.5.9)
(1.5.9)
или
![]() (1.5.10)
(1.5.10)
Уравнение (1.5.10) также имеет вид уравнения Тафеля.
В области малых перенапряжений, где ![]() намного меньше значения
намного меньше значения ![]() , можно разложить экспоненты в уравнении (1.5.5) и ограничиться первыми двумя членами разложения:
, можно разложить экспоненты в уравнении (1.5.5) и ограничиться первыми двумя членами разложения:
![]() (1.5.11)
(1.5.11)
откуда
![]() (1.5.12)
(1.5.12)
Таким образом, вблизи равновесного потенциала должна наблюдаться линейная зависимость между ![]() и
и ![]() .
.
Из соотношения (1.5.12) видно, что чем больше ток обмена, тем меньше отклонение потенциала от его равновесного значения при данной плотности тока и наоборот. На основе уравнения (1.5.12) можно дать более строгое определение понятиям идеально поляризуемого и идеально неполяризуемого электродов. Так, идеально поляризуемый электрод – это такой электрод, плотность тока обмена на котором равна нулю: ![]() . Если бы не было двойного слоя, любой сколь угодно малый ток вызвал бы бесконечно большое смещение потенциала. Идеально неполяризуемый электрод – это электрод, которому отвечает бесконечно большой ток обмена:
. Если бы не было двойного слоя, любой сколь угодно малый ток вызвал бы бесконечно большое смещение потенциала. Идеально неполяризуемый электрод – это электрод, которому отвечает бесконечно большой ток обмена: ![]() . Реальный ток обмена всегда имеет некоторую конечную величину. Но если
. Реальный ток обмена всегда имеет некоторую конечную величину. Но если ![]() оказывается значительно больше протекающего через электрод тока
оказывается значительно больше протекающего через электрод тока ![]() , то согласно уравнению (1.5.12) изменением потенциала этого электрода можно пренебречь. Так как при условии, что
, то согласно уравнению (1.5.12) изменением потенциала этого электрода можно пренебречь. Так как при условии, что ![]() , сдвиг потенциала электрода не должен превышать 2,5 мкВ. Поэтому в качестве электродов сравнения обычно выбирают электрохимические системы с достаточно большими токами обмена. Если
, сдвиг потенциала электрода не должен превышать 2,5 мкВ. Поэтому в качестве электродов сравнения обычно выбирают электрохимические системы с достаточно большими токами обмена. Если ![]() , то уравнение (1.5.5) преобразуется:
, то уравнение (1.5.5) преобразуется:
