Равновесные и поляризационные диаграммы потенциал-pH
Для данной системы построена равновесная диаграмма потенциал – pH:
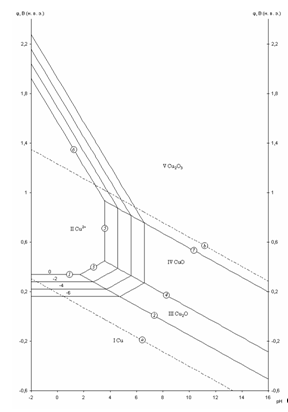
Рис. 2.1 - Равновесная диаграмма потенциал – pH для системы Cu – H2O
На диаграмме можно выделить 5 областей преобладания фаз различного состава. Область I – область иммунности меди, при данных значениях потенциалов и рН медь коррозии не подвергается. Область II – область активной коррозии, в которой медь переходит в раствор в виде катионов Cu2+. Области III, IV – области пассивации, на поверхности меди образуется защитная пассивирующая плёнка, состоящая из оксида Cu2O (область III) и CuO (область IV) Область V – область перепассивации. Линии a и b на диаграмме определяют область электрохимической устойчивости воды.
Данная диаграмма построена без учета существования Cu в данной системе в виде анионов.
Ниже приведены дополняющие картину системы уравнений реакций:
(VIII) HCuO2- + H+ = CuO + H2O pH = 18,83 + lg![]()
(IX) Cu2O3 +H2O + 2ē = 2HCuO2- φ = ?
(X) 2HCuO2- + 4H+ + 2ē = Cu2O +3H2O φ = 1,783 – 0,1182pH + 0,0591·lg![]()
(XI) CuO22- + H+ = HCuO2- pH = 13,15 + lg![]()
(XII) 2CuO22- + 6H+ + 2ē = Cu2O + 3H2O φ = 2,560 – 0,1773pH + 0,0591·lg![]()
(XIII) Cu2O3 + H2O + 2ē = 2CuO22- + 2H+ φ = ?
(XIV) CuO22- + 4H+ + 2ē = Cu + 2H2O φ = 1,515 – 0,1182pH + 0,0295·lg![]()
Аналогично расчетам для уравнений реакций (I) – (VII) для реакций (IX) и (XIII) получаем:
φ(IX) = 0,0309 –0,0591·lg![]()
φ(XIII) = –0,759 + 0,0591pH + 0,0591·lg![]()
Для системы Cu – H2O построена дополненная диаграмма потенциал – pH:
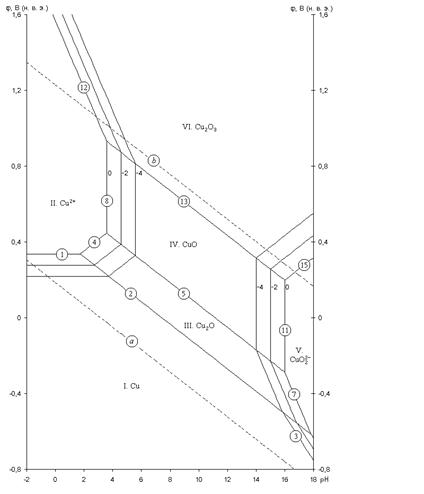
Рис. 2.2 - Равновесная диаграмма потенциал – pH для системы Cu – H2O с учетом существования Cu в виде анионов
На данной диаграмме показаны все условия перехода меди из одних состояний в другие. Можно заметить, что в очень кислой среде пассивирующая пленка меди разрешается, вследствие чего медь вновь переходит в раствор, но на этот раз уже в виде анионов HCuO2- и CuO22-. Отсюда можно сделать вывод, что медь неустойчивак коррозии при высоких значениях pH.
Выводы
1) В работе изучены основные представления о электрохимических системах, рассмотрены классификация электродов и классификация самих систем.
2) Рассмотрены равновесные диаграммы потенциал-pH, изучены основные принципы их построения и анализа.
3) Изучены поляризационные кривые и поляризационные диаграммы потенциал-pH, принципы их построения, перехода от кривых к диаграммам.
4) В работе рассчитаны основные химические и электрохимические равновесия в системе Cu – H2O при 298 К и 1 атм. На основе этих данных построена диаграмма электрохимического равновесия данной системы.
5) Были проанализированы термодинамические особенности окисления меди на воздухе. Показано принципиальная возможность образования оксида Cu2O3 в стандартных условиях.
СПИСОК ЛИТЕРАТУРЫ
1. Герасимов Я.И. Курс физической химии [Текст] / Я.И. Герасимов, В.П. Древинг, Е.Н. Еремин, А.В. Киселев, В.П. Лебедев, Г.М. Панченков, А.И. Шлыгин // – 2-е изд., знач. доп. – М: Химия, 1973. Т. 2 – 624 с.
2. Дамаскин Б.Б. Электрохимия: учебное пособие для хим. фак. ун-тов [Текст] / Б.Б. Дамаскин, О.А. Петрий // М: Высшая школа, 1987. – 295 с.
3. Термодинамика химической и электрохимической устойчивости сплавов: учебное пособие [Текст] / авт.-сост. А.Г. Тюрин. Ч.I. – Челябинск: ЧелГУ, 2004.
4. Киш Л. Кинетика электрохимического растворения металлов [Текст] / пер. с англ. Е.В. Овсянниковой; под ред. А.М. Скундина // – М: Мир, 1990. – 272 с.
5. Скорчеллетти В.В. Теоретическая электрохимия. – Л: Государственное Научно-техническое издательство химической литературы, 1963. – 608 с.
6. Тюрин А.Г. Термодинамика химической и электрохимической устойчивости сплавов: [Текст]: дис. докт. хим. наук / Тюрин Александр Георгиевич – Челябинск: 2007.
7. Дамаскин Б.Б. Введение в электрохимическую кинетику: Учеб. пособие для студентов хим. спец. ун-тов [Текст] / Б.Б. Дамаскин, О.А. Петрий // – 2-е изд., перераб. и доп. – М: Высшая школа, 1983.
