Равновесные и поляризационные диаграммы потенциал-pH
Аналогично для гальвани-потенциала на правой границе имеем
![]() (1.2.18)
(1.2.18)
Сумма этих гальвани-потенциалов равна
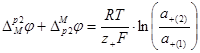 (1.2.19)
(1.2.19)
Чтобы получить разность потенциалов на концах цепи, к сумме гальвани-потенциалов ![]() нужно прибавить диффузионный потенциал на границе двух растворов
нужно прибавить диффузионный потенциал на границе двух растворов ![]() .
.
Для рассматриваемой системы:
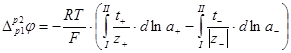 (1.2.20)
(1.2.20)
Если предположить, что концентрации двух растворов отличаются не очень сильно или оба раствора достаточно разбавлены и, следовательно, можно принять постоянство чисел переноса в переходной зоне на границе двух растворов, то из уравнения (1.2.20) находим
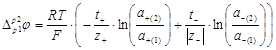 (1.2.21)
(1.2.21)
Складывая уравнения (1.2.19) и (1.2.21) и заменяя при этом z+=n/υ+ и │z -│=n/υ- получаем для разности потенциалов на концах цепи:
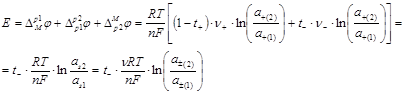 (1.2.22)
(1.2.22)
где ![]() - активность соли;
- активность соли; ![]() - средняя активность.
- средняя активность.
При работе цепи, когда ![]() >
>![]() , Е>0, следовательно, на правом электроде идет катодный процесс выделения металла. Если через цепь прошел 1 фарадей электричества, то за счет электролиза из правого раствора будет удален 1 г-экв катионов. Но через границу двух растворов в правую часть цепи перейдет t+ г-экв катионов, так что суммарная убыль катионов из правого раствора составит 1– t+= t- г-экв. Одновременно из правого раствора в левый перейдет t- г-экв анионов. Таким образом, прохождение через цепь 1 фарадея сопровождается убылью t- г-экв соли из правого раствора. Аналогичный анализ процессов в левой части цепи показывает, что при прохождении через цепь 1 фарадея здесь возникает t- г-экв соли. Следовательно, работа концентрационной цепи с переносом сопровождается выравниванием концентраций в обоих растворах. Данный вывод оказывается справедливым и при условии
, Е>0, следовательно, на правом электроде идет катодный процесс выделения металла. Если через цепь прошел 1 фарадей электричества, то за счет электролиза из правого раствора будет удален 1 г-экв катионов. Но через границу двух растворов в правую часть цепи перейдет t+ г-экв катионов, так что суммарная убыль катионов из правого раствора составит 1– t+= t- г-экв. Одновременно из правого раствора в левый перейдет t- г-экв анионов. Таким образом, прохождение через цепь 1 фарадея сопровождается убылью t- г-экв соли из правого раствора. Аналогичный анализ процессов в левой части цепи показывает, что при прохождении через цепь 1 фарадея здесь возникает t- г-экв соли. Следовательно, работа концентрационной цепи с переносом сопровождается выравниванием концентраций в обоих растворах. Данный вывод оказывается справедливым и при условии ![]() <
<![]() , но при этом все процессы в цепи протекают в обратном направлении.
, но при этом все процессы в цепи протекают в обратном направлении.
В химических цепях источником электрической энергии является свободная энергия химической реакции, протекающей в электрохимической системе.
В химических цепях без переноса один из электродов должен быть обратимым по катиону, а другой – по аниону.
Примеры:
амальгамный электрод – электрод 2-ого рода:
Ag│K(Hg)│KCl│AgCl, Ag
газовый электрод – электрод 2-ого рода:
обратимый по катионам
Pt, H2│HCl│Hg2Cl2, Hg│Pt
обратимый по анионам
Pt, H2│HCl│Cl2, Pt
электрод 1-ого рода – газовый электрод:
Zn│ZnCl2│Cl2, Pt│Zn
Среди различных химических цепей без переноса большое значение имеет цепь
Pt│Cd(Hg)│CdSO4 (насыщенный раствор)│Hg2SO4, Hg│Pt
лежащая в основе стандартного элемента Вестона. ЭДС этого элемента отличается большой стабильностью и малым температурным коэффициентом, а потому он используется в качестве стандарта при потенциометрических измерениях.
Однако подавляющее большинство химических цепей – это цепи с переносом, в которых растворы соединены или непосредственно, или через солевой мостик. Комбинируя различные окислительно-восстановительные полуреакции, можно построить очень большое число химических цепей. Разность соответствующих стандартных потенциалов позволяет в первом приближении оценить ЭДС этих цепей. Точное значение разности потенциалов на концах химической цепи в переносом рассчитать не удается, во-первых, из-за невозможности точного определения диффузионного потенциала и, во-вторых, из-за неизбежной замены активностей отдельных ионов в формуле Нернста средними активностями или прсото концентрациями этих ионов.
Пример химической цепи с переносом: элемент Даниэля – Якоби:
Cu│Zn│ZnSO4¦CuSO4│Cu
Разность потенциалов на концах этой цепи равна
![]() (1.2.23)
(1.2.23)
1.3 Равновесные диаграммы потенциал-pH (диаграммы Пурбе или диаграммы электрохимического равновесия). Принципы построения. Использование диаграмм Пурбе
Одним из наиболее значительных достижений электрохимии 60-х годов является построение диаграмм pH-потенциал для всех важных металлов, названных в честь автора диаграммами Пурбе.
Диаграммы характеризуют, прежде всего, состав водного раствора и термодинамическую устойчивость твердой фазы (металла, оксидов, гидрооксидов и других соединений) в зависимости от двух переменных – электродного потенциала φ и pH. Каждая диаграмма построена в предположении, что все другие переменные заданы, но изменение состава водного раствора по еще одной переменной, например по концентрации иона металла, можно отобразить семейством линий. На полных диаграммах pH-потенциал наносят семейства линий при активностях ионов в растворе, равных 100, 10-2, 10-4, 10-6М. Эти линии обозначают соответственно числами 0, -2, -4 и -6. Для характеристики коррозионных процессов используют упрощенные диаграммы Ph=-потенциал. Для этого или объединяют кривые, соответствующие разным активностям ионов в водном растворе, проводя усредненную кривую, или строят диаграмму только при ![]() =10-6М.
=10-6М.
Для расчета и построения диаграмм pH-потенциал необходимо располагать сведениями о химических и электрохимических реакциях, возможных в данной системе, об их количественных термодинамических характеристиках (энергиях Гиббса, стандартных электродных потенциалах, их температурных коэффициентах).
В области низких температур (0 – 100°С) энергию Гиббса реакции достаточно рассчитывать в приближении Улига:
![]() (1.3.1)
(1.3.1)
Величину стандартного электродного потенциала можно определить по уравнению
![]() (1.3.2)
(1.3.2)
В справочной литературе стандартные потенциалы отнесены к температуре 298К, их величины при других температурах могут быть найдены из уравнения (1.3.2) или по соответствующим изотермическим температурным коэффициентам. Первый изотермический коэффициент отражает изменение стандартной энтропии электродной реакции:
![]() (1.3.3)
(1.3.3)
а второй – изменение изобарных теплоемкостей
