Термодинамика химической и электрохимической устойчивости медно-никелевых сплавов
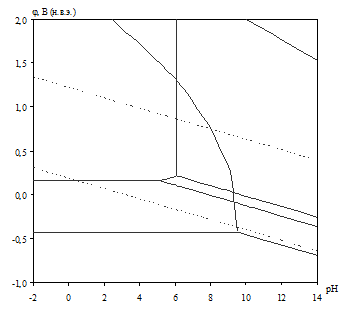
Рис. 2.4. Диаграмма рН – потенциал системы сплав МН19 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]() .
.
Табл. 2.10. Основные химические и электрохимические равновесия в системе сплав МН19 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]()
|
№ линии |
Электродная реакция |
Равновесный потенциал (В) или рН раствора |
|
1 |
|
-0,425 |
|
2 |
|
0,135–0,0591pH |
|
3 |
|
|
|
4 |
|
0,161 |
|
5 |
|
0,465–0,0591pH |
|
6 |
|
0,575–0,0591pH |
|
7 |
|
-0,144+0,0591pH |
|
8 |
|
pH 6,08 |
|
9 |
|
3,183–0,1182pH |
На диаграмме рН – потенциал системы сплав МН19 – Н2О (вне зависимости от того, какими заданы активности ионов в растворе) можно выделить 10 областей преобладания различных фаз:
I. α (мельхиор МН19),
II. α + Ni2+,
III. α + NiOx,
IV. Cu2O + Ni2+,
V. Cu2O + NiOx,
VI. Cu2+, Ni2+,
VII. NiOx + Cu2+,
VIII. CuO + Ni2+,
IX. CuO + NiOx,
X. CuO + ![]() .
.
В области I сплав МН19 не подвергается коррозии (иммунность), в областях II и VI сплав корродирует, причём в области II происходит селективная коррозия никеля из сплава, а в области VI – общая коррозия сплава. В областях III–V и VII–IX происходит образование на поверхности сплава пассивационной оксидной плёнки, которая может быть как однофазной (области III–IV, VII–VIII), так и двухфазной (V, IX). В области Х происходит перепассивация сплава по никелю (окисление пассивационной плёнки и переход никеля в раствор в виде никелат-ионов).
Сравнение диаграмм, построенных при различных значениях активностей ионов в растворе, показывает, что с уменьшением активностей ионов снижаются потенциалы растворения компонентов сплава и потенциал перепассивации мельхиора по никелю. Области активной коррозии расширяются, а области пассивности наоборот уменьшаются и сдвигаются в щелочную область.
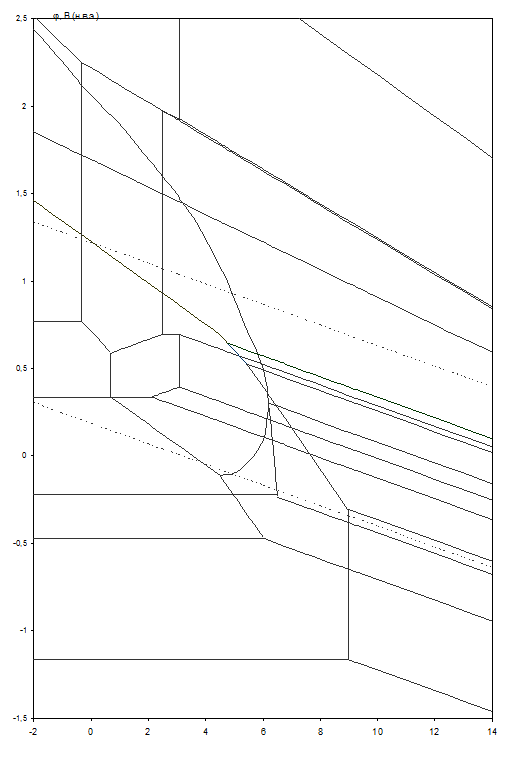
Рис. 2.5. Диаграмма рН – потенциал системы сплав МНЖМц30–1–1 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]() .
.
Табл. 2.11. Основные химические и электрохимические равновесия в системе сплав МНЖМц30–1–1 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]()
|
№ линии |
Электродная реакция |
Равновесный потенциал (В) или рН раствора |
|
1 |
|
-1,165 |
|
2 |
|
-0,473 |
|
3 |
|
-0,233 |
|
4 |
|
0,337 |
|
5 |
|
0,771 |
|
6 |
|
-0,634–0,0591pH |
|
7 |
|
pH 8,95 |
|
8 |
|
-0,117–0,0591pH |
|
9 |
|
0,150–0,0591pH |
|
10 |
|
0,225–0,0591pH |
|
11 |
|
0,953–0,2364pH |
|
12 |
|
|
|
13 |
|
pH 6,23+ |
|
14 |
|
0,420–0,1182pH |
|
15 |
|
0,463–0,0591pH |
|
16 |
|
0,575–0,0591pH |
|
17 |
|
0,211+0,0591pH |
|
18 |
|
0,668–0,0591pH |
|
19 |
|
pH 0,70 |
|
20 |
|
0,713–0,1773pH |
|
21 |
|
0,546+0,0591pH |
|
22 |
|
pH 3,08 |
|
23 |
|
0,695 |
|
24 |
|
0,877–0,0591pH |
|
25 |
|
1,813–0,2364pH |
|
26 |
|
1,490–0,1773pH |
|
27 |
|
0,846–0,0591pH |
|
28 |
|
0,926–0,0591pH |
|
29 |
|
1,226–0,1182pH |
|
30 |
|
1,695–0,0788pH |
|
31 |
|
pH -0,32 |
|
32 |
|
pH 2,53 |
|
33 |
|
2,200–0,1577pH |
|
34 |
|
2,220–0,0985pH |
|
35 |
|
2,169–0,0788pH |
|
36 |
|
2,230–0,0985pH |
|
37 |
|
3,360–0,1182pH |
