Термодинамика химической и электрохимической устойчивости медно-никелевых сплавов
Cu | Cu2O | CuO | {O2}.
Фазовая диаграмма состояния Ni – O приведена на рис. 1.4 [14].
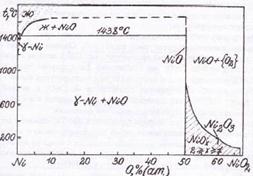
Рис. 1.4. Диаграмма состояния Ni – O
Из рис. 1.4. следует, что при температурах ниже 200˚С в системе никель – кислород наблюдается следующая последовательность равновесий Ni | NiO | NiOx | NiO2 | {O2}.
Здесь NiOx – фаза нестехиометрического состава, непрерывный ряд твёрдых растворов между NiO и NiO2. 1<x<2.
1.7 Диаграммы рН – потенциал систем Cu – H2O и Ni – H2O
Диаграмма рН – потенциал системы Cu – H2O приведена на рис. 1.5. Основные химические и электрохимические равновесия указаны в табл. 1.10.
Диаграмма рН – потенциал системы Ni – H2O приведена на рис. 1.6. Основные химические и электрохимические равновесия указаны в табл. 1.11.
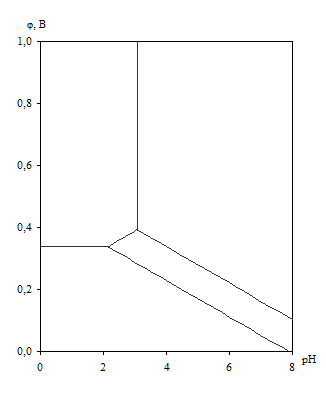
Рис. 1.5. Диаграмма рН – потенциал системы Cu – H2O при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]() (негидратированная форма оксидов).
(негидратированная форма оксидов).
Табл. 1.10. Основные химические и электрохимические равновесия в системе Cu – H2O при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]() (негидратированная форма оксидов)
(негидратированная форма оксидов)
|
№ линии |
Электродная реакция |
Равновесный потенциал (В) или рН раствора |
|
1 |
|
0,337 |
|
2 |
|
0,463–0,0591pH |
|
3 |
|
0,575–0,0591pH |
|
4 |
|
0,211+0,0591pH |
|
5 |
|
pH 3,08 |
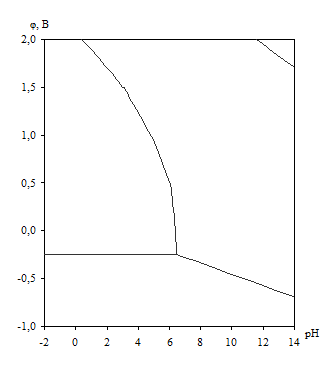
Рис. 1.6. Диаграмма рН – потенциал системы Ni – H2O при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]() (негидратированная форма оксидов).
(негидратированная форма оксидов).
Табл. 1.11. Основные химические и электрохимические равновесия в системе Ni – H2O при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]() (негидратированная форма оксидов)
(негидратированная форма оксидов)
|
№ линии |
Электродная реакция |
Равновесный потенциал (В) или рН раствора |
|
1 |
|
-0,250 |
|
2 |
|
0,133–0,0591pH |
|
3 |
|
|
|
4 |
|
3,36–0,1182pH |
Как видно из рис. 1.5., на диаграмме рН – потенциал системы Cu – H2O можно выделить 4 области преобладания различных фаз:
I – Cu
II – Cu2+
III – Cu2O
IV – CuO.
В области I медь не подвержена коррозии (область иммунности). В области II медь переходит в раствор в виде двухзарядных ионов (область активной коррозии). В областях III и IV на поверхности меди образуется плёнка оксида – Cu2O в области III и CuO области IV (области пассивности).
На диаграмме рН – потенциал системы Ni – H2O (рис. 1.6.) также можно выделить 4 области преобладания различных фаз:
I – Ni – область иммунности
II – Ni2+ – область активной коррозии
III – NiOx – область пассивности
IV – ![]() – область транспассивности.
– область транспассивности.
2. Экспериментальная часть
2.1 Справочные термодинамические данные для расчётов системы Cu – Ni – O
Все данные, представленные в табл. 2.1. – 2.3. получены из справочной литературы [17].
Табл. 2.1. Стандартные энергии Гиббса образования некоторых соединений
|
Cоединение |
|
Соединение |
|
|
Cu2O(т) |
147,878 |
Fe3O4(т) |
1020,233 |
|
CuO(т) |
127,890 |
Fe2O3(т) |
744,224 |
|
CuFeO2(т) |
478,300 |
MnO(т) |
362,770 |
|
CuFe2O4(т) |
887,480 |
Mn3O4(т) |
1281,955 |
|
NiO(т) |
211,430 |
Mn2O3(т) |
879,280 |
|
NiO2(т) |
111,630 |
MnO2(т) |
465,370 |
|
NiFe2O4(т) |
958,600 |
Mn2O7(ж) |
262,940 |
