Термодинамика химической и электрохимической устойчивости медно-никелевых сплавов
Для каждой из температур проведены вычисления значений энергий смешения. Результаты вычислений приведены в табл. 1.7, а график температурной зависимости энергий смешения – на рис. 1.2.
Табл. 1.7. Значения энергий смешения компонентов системы Cu – Ni при различных температурах
|
T, K |
Q12(1), Дж/моль |
Q12(2), Дж/моль |
|
473 |
-3197,73 |
15175,28 |
|
498 |
-465,22 |
13963,91 |
|
523 |
642,88 |
12621,02 |
|
548 |
-507,40 |
11923,95 |
|
573 |
870,69 |
11582,78 |
|
598 |
2055,72 |
11269,64 |
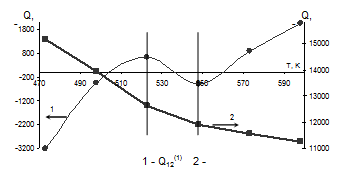
Рис. 1.2. Зависимости энергий смешения компонентов системы Cu – Ni от температуры
На основании полученных данных были вычислены уравнения температурной зависимости энергий смешения в области низких температур.
![]() (1.13)
(1.13)
![]() (1.14) [11].
(1.14) [11].
1.5 Энергетические параметры обобщённой теории «регулярных» растворов для систем Cu – Fe, Cu – Mn, Ni – Fe, Ni – Mn, Fe – Mn
Железо условно обозначено, как компонент 3, а марганец – как компонент 4. Так как основные компоненты (медь и никель) образуют раствор с решёткой ГЦК, то и железо и марганец при растворении перестраиваются в ГЦК решётку. Поэтому все значения энергий смешения приведены для решётки ГЦК. Они представлены в табл. 1.8 – 1.9.
Табл. 1.8. Температурные зависимости энергий смешения
|
Бинарная система |
|
|
Ссылка | |
|
Cu – Fe |
1; 3 |
|
|
[13] |
|
Cu – Mn |
1; 4 |
|
|
[12] |
|
Ni – Fe |
2; 3 |
|
|
[13] |
|
Ni – Mn |
2; 4 |
|
|
[13] |
|
Fe – Mn |
3; 4 |
|
|
[13] |
Табл. 1.9. Значения энергий смешения при Т=298 К
|
Бинарная система |
|
| |
|
Cu – Ni |
1; 2 |
-16369 |
24137 |
|
Cu – Fe |
1; 3 |
37800 |
37800 |
|
Cu – Mn |
1; 4 |
1252 |
1252 |
|
Ni – Fe |
2; 3 |
-37253 |
1796 |
|
Ni – Mn |
2; 4 |
-61192 |
-48640 |
|
Fe – Mn |
3; 4 |
-13808 |
-13808 |
1.6 Диаграммы состояния систем Cu – O и Ni – О
Фазовая диаграмма состояния Cu – O приведена на рис. 1.3 [9].
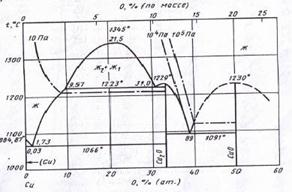
Рис. 1.3. Диаграмма состояния Cu – O.
Из рис. 3. следует, что при температурах ниже 1000˚С в системе медь – кислород наблюдается следующая последовательность равновесий
