Термодинамика химической и электрохимической устойчивости медно-никелевых сплавов
На диаграмме можно выделить 48 областей преобладания различных фаз:
I. α (мельхиор МНЖМц30–1–1),
II. α + Mn2+,
III. α + MnO,
IV.α + Mn2+, Fe2+,
V. α + [(Fe1-xNix) Fe2O4] + Mn2+,
VI.α + [(Fe1-xNix) Fe2O4] + MnO,
VII. α + Mn2+, Ni2+, Fe2+,
VIII. α + CuFeO2 + Ni2+, Mn2+,
IX.α + CuFeO2 + [(Fe1-xNix) Fe2O4] + Ni2+, Mn2+,
X. α + CuFeO2 + [(Fe1-xNix) Fe2O4] + NiOx + Mn2+,
XI.α + CuFeO2 + [(Fe1-xNix) Fe2O4] + NiOx + MnO,
XII. α + CuFeO2 + [(Fe1-x-yNixMny) (Fe2-zMnzO4)] + NiOx,
XIII. Cu2+, Mn2+, Fe2+, Ni2+,
XIV. CuFeO2 + Mn2+, Ni2+,
XV. Cu2O + CuFeO2 + Mn2+, Ni2+,
XVI. CuO + CuFeO2 + Mn2+, Ni2+,
XVII. Cu2O + CuFeO2 + [(Fe1-xNix) Fe2O4] + Mn2+, Ni2+,
XVIII. Cu2O + CuFeO2 + [(Fe1-xNix) Fe2O4] + NiOx + Mn2+,
XIX. Cu2O + CuFeO2 + [(Fe1-x-yNixMny) (Fe2-zMnzO4)] + NiOx,
XX. CuO + CuFeO2 + [(Fe1-xNix) Fe2O4] + Mn2+, Ni2+,
XXI. CuO + CuFeO2 + [(Fe1-xNix) Fe2O4] + NiOx + Mn2+,
XXII. CuO + CuFeO2 + [(Fe1-x-yNixMny) (Fe2-zMnzO4)] + NiOx,
XXIII. CuO + CuFeO2 + Mn3O4 + Ni2+,
XXIV. CuO + CuFeO2 + NiOx + Mn2+,
XXV. CuO + CuFeO2 + NiOx + Mn3O4,
XXVI. CuO + CuFeO2 + Mn2O3 + Ni2+,
XXVII. CuO + CuFeO2 + NiOx + Mn2O3,
XXVIII. CuFe2O4 + Mn2O3 + Ni2+,
XXIX. CuFe2O4 + Mn2O3 + NiOx,
XXX. Cu2+, Mn2+, Fe3+, Ni2+,
XXXI. Fe2O3 + Cu2+, Mn2+, Ni2+,
XXXII. CuFe2O4 + Ni2+, Mn2+,
XXXIII. CuFe2O4 + MnO2 + Ni2+,
XXXIV. CuFe2O4 + NiOx + MnO2,
XXXV. Cu2+, Mn3+, Fe3+, Ni2+,
XXXVI. MnO2 + Cu2+, Ni2+, Fe3+,
XXXVII. MnO2 + Fe2O3 + Cu2+, Ni2+,
XXXVIII. Cu2+, Fe3+, Ni2+,![]() ,
,
XXXIX. Fe2O3 + Cu2+, Ni2+,![]() ,
,
XL. CuFe2O4 + Ni2+,![]() ,
,
XLI. CuFe2O4 + NiOx + ![]() ,
,
XLII. CuFe2O4 + NiOx + ![]() ,
,
XLIII. Fe2O3 + NiOx + Cu2+, ![]() ,
,
XLIV. CuFe2O4 + NiOx + ![]() ,
,
XLV. Cu2+, Ni2+, ![]() ,
,
XLVI. NiOx + Cu2+ + ![]() ,
,
XLVII. CuO + NiOx + ![]() ,
,
XLVIII. CuO + ![]() .
.
Диаграмма рН – потенциал системы сплав МНЖМц30–1–1 – Н2О при условии ![]() приведена на рис. 2.7. Основные химические и электрохимические равновесия указаны в табл. 2.13.
приведена на рис. 2.7. Основные химические и электрохимические равновесия указаны в табл. 2.13.
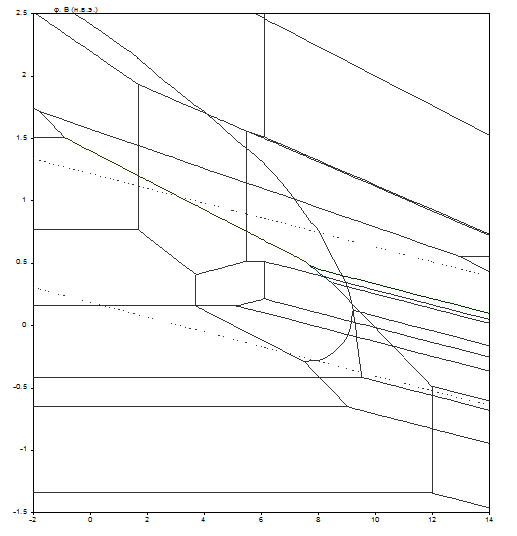
Рис. 2.7. Диаграмма рН – потенциал системы сплав МНЖМц30–1–1 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]() .
.
Табл. 2.13. Основные химические и электрохимические равновесия в системе сплав МНЖМц30–1–1 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]()
|
№ линии |
Электродная реакция |
Равновесный потенциал (В) или рН раствора |
|
1 |
|
-1,342 |
|
2 |
|
-0,650 |
|
3 |
|
-0,410 |
|
4 |
|
0,160 |
|
5 |
|
0,771 |
|
6 |
|
1,510 |
|
7 |
|
-0,634–0,0591pH |
|
8 |
|
pH 11,95 |
|
9 |
|
-0,117–0,0591pH |
|
10 |
|
0,150–0,0591pH |
|
11 |
|
0,225–0,0591pH |
|
12 |
|
1,485–0,2364pH |
|
13 |
|
|
|
14 |
|
pH 9,23+ |
|
15 |
|
0,597–0,1182pH |
|
16 |
|
0,463–0,0591pH |
|
17 |
|
0,575–0,0591pH |
|
18 |
|
-0,144+0,0591pH |
|
19 |
|
0,668–0,0591pH |
|
20 |
|
pH 3,70 |
|
21 |
|
1,068–0,1773pH |
|
22 |
|
0,191+0,0591pH |
|
23 |
|
pH 6,08 |
|
24 |
|
0,518 |
|
25 |
|
0,877–0,0591pH |
|
26 |
|
2,345–0,2364pH |
|
27 |
|
1,845–0,1773pH |
|
28 |
|
0,846–0,0591pH |
|
29 |
|
0,926–0,0591pH |
|
30 |
|
1,403–0,1182pH |
|
31 |
|
1,506–0,1182pH |
|
32 |
|
1,295–0,2364pH |
|
33 |
|
1,577–0,0788pH |
|
34 |
|
0,588 |
|
35 |
|
2,087–0,1182pH |
|
36 |
|
pH 1,68 |
|
37 |
|
pH 5,53 |
|
38 |
|
2,200–0,1577pH |
|
39 |
|
2,102–0,0985pH |
|
40 |
|
1,992–0,0788pH |
|
41 |
|
2,112–0,0985pH |
|
42 |
|
3,183–0,1182pH |
