Химия и технология штатных бризантных взрывчатых веществ
Вторая мировая война потребовала еще большего количества взрывчатых веществ. Расход их значительно превысил расход во время первой мировой войны.
В связи с острым недостатком взрывчатых веществ делались попытки расширить их номенклатуру путем использования новой сырьевой базы, однако эти попытки успеха не имели.
Основным бризантным взрывчатым веществом во время второй мировой войны был тротил. Если в первую мировую войну применялись в значительных количествах и другие нитропроизводные ароматических углеводородов, то во вторую мировую войну тротил или взрывчатые смеси на его основе использовались особенно широко. Так, удельный вес производства тротила в германской промышленности составлял более 50% производства всех взрывчатых веществ.
Широкое применение во время второй мировой войны приобрели наиболее мощные взрывчатые вещества – гексоген и тэн, которые в первой мировой войне не применялись. Особенно большое внимание было уделено развитию промышленности этих веществ в странах, не обеспеченных в достаточной мере собственными источниками сырья для производства взрывчатых веществ на базе ароматических соединений. Например, в Италии гексоген и тэн начали изготовлять в массовом масштабе уже в 1932–1933 гг. оба эти вещества использовались итальянцами для снаряжения боеприпасов не только в чистом виде, но и в смесях с аммонийной селитрой. В Германии широко применяли для снаряжения бронебойных и кумулятивных снарядов. Тэн и гексоген производили также во Франции, Англии, Канаде, США.
3. По составу бризантные взрывчатые вещества разделяются на две большие группы: химические соединения и взрывчатые смеси.
В первую группу входят следующие важнейшие классы взрывчатых веществ:
1) нитросоединения – органические соединения, содержащие одну или несколько групп C-NO2 (тротил). Наибольшее значение имеют полинитропроизводные ароматических соединений. Значительная часть нитросоединений алифатических углеводородов также является ВВ, но лишь немногие из них имеют практическое значение;
2) нитроамины – органические соединения, содержащие группы N-NO2 (гексоген, тетрил);
3) эфиры азотной кислоты – органические соединения, содержащие группы О-NO2 (тэн) В качестве ВВ применяются азотнокислые эфиры спиртов и углеводов;
4) соли азотной кислоты. Наибольшее применение имеет нитрат аммония (NH4NO3), а также нитраты органических оснований (мочевины, метиламина и др.).
Вторую группу составляют взрывчатые смеси, содержащие и не содержащие ВВ.
К важнейшим классам взрывчатых смесей, содержащим взрывчатые компоненты, относятся:
1) аммониты или аммонийноселитренные ВВ, состоящие из смеси аммонийной селитры с нитросоединениями;
2) сплавы и смеси нитросоединений;
3) нитроглицериновые ВВ (динамиты);
4) хлоратные и перхлоратные ВВ – смеси хлорноватой или хлорной кислот с нитросоединениями и др.
В состав смесей, состоящих из невзрывчатых компонентов, входят горючие вещества и соединения, содержащие значительное количество кислорода или другого окислителя. Реакция взрыва в этом случаи заключается в окислении элементов, входящих в горючие вещества, кислородом, содержащимся в окислителях. Взрывчатые смеси из невзрывчатых компонентов могут быть разбиты на следующие классы:
1) дымные пороха – смеси селитры и угля;
2) оксиликвиты – смеси жидкого кислорода с горючими веществами;
3) смеси концентрированной азотной кислоты или другого жидкого окислителя с горючими веществами.
Из взрывчатых смесей наибольшее значение имеют аммонийноселитренные ВВ.
Артиллерия предъявляет очень жесткие требования к бризантным ВВ. Они должны обладать большой мощностью, быть безопасными в обращении, иметь достаточную чувствительность к начальному импульсу, быть стойкими при хранении. Кроме всего перечисленного, бризантное ВВ, принятое на вооружение, должно быть обеспечено сырьевой базой и метод производства его должен быть достаточно прост и безопасен.
Применяемые в настоящее время взрывчатые вещества далеко не в полной мере удовлетворяют перечисленным требованиям и поэтому изыскание новых мощных взрывчатых веществ, обладающих указанными выше свойствами, является важной задачей ученых и инженеров, работающих в этой области. Одновременно актуальна и проблема усовершенствования технологии производства ВВ с целью снижения опасности их изготовления и повышения производительности труда, и как следствие – снижение себестоимости продукта.
Занятие 2
Тема занятия: Тротил. Тэн.
Цель занятия: Дать учащимся общее представление о тротиле, о тэне, познакомить со свойствами и методами получения тротила, тэна.
План занятия а:
1. Свойства тротила и тэна.
2. Получение тротила и тэна.
3. Применение тротила и тэна.
Ход занятия:
1. Тротил по внешнему виду представляет собой желтое вещество. Температура плавления очищенного тротила 80,6°С, при наличии примесей температура плавления снижается до 75–77°С. Примеси образуют с тротилом многокомпонентные эвтектические сплавы, имеющие маслообразный вид, вследствие чего их называют тротиловым маслом.
Плотность монокристалла тротила 1,663 г./см. Гигроскопичность около 0,05%, растворимость в воде низкая – 0,15% при 100°С, что является благоприятным свойством.
Тротил токсичен, предельно допустимая концентрация 0,001 мг/л, он поражает дыхательные пути, пищеварительный тракт. При длительном воздействии вызывает слабость, головокружение, дерматиты кожи, гепатит,
Тэн представляет собой белое кристаллическое вещество с температурой плавления 141–142°С и плотностью 1,77 г./см, плохо прессуется. Прессованием можно достичь плотности 1,6 г/см. Размер частиц 10–830 мкм.
Тэн не гигроскопичен, растворимость его в воде при 19°С 0,01%, а при 100°С – 0,035%. Тэн химически стоек, более чувствителен к механическим воздействиям, чем гексоген и октоген. Температура вспышки 205–225°С.
Тэн – токсическое вещество, вызывает раздражение верхних дыхательных путей, покраснение слизистых оболочек и кожи; при попадании в легкие вызывает расширение кровеносных сосудов.
2. Тротил получают нитрацией толуола смесью азотной и серной кислот.
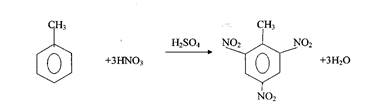
Тэн – сложный эфир азотной кислоты и четырехатомного спирта – пентаэритрита С(СН2ОН)4.
С(СН2ОН)4 + 4HNО3 → С(СН2ONО2)4 + 4Н2О
3. Тротил в чистом виде или смеси с гексогеном (смеси ТГ, состав В) или тэном (пентолит) широко применяется в виде литых и прессованных шашек в качестве промежуточных детонаторов, кумулятивных зарядов для дробления негабаритных кусков породы, зарядов для сейсморазведки.
Чистый тэн используется для снаряжение средств инициирования и детонирующих шнуров, для прессованных дополнительных детонаторов, а также в эластичных ВВ.
Занятие 3
Тема занятия: Гексоген. Октоген.
Цель занятия: Дать учащимся общее представление о гексогене и октогене, познакомить со свойствами и методами получения гексогена и октогена.
План занятия:
1. Свойства гексогена и октогена.
