Химия и технология штатных бризантных взрывчатых веществ
В 1956 году К.Г. Костырев, С.С. Молчанова, Л.Ф. Николаева и др. показали, что способ нитрования пентаэритрита концентрированной азотной кислотой является более безопасным и позволяет получать тэн высокого качества из пентаэритрита с температурой плавления не ниже 230°С. В 1957 году на Чапаевском химзаводе и в 1966 году на Бийском олеумном заводе была внедрена технология производства тэна по периодическому способу этерификацией пентаэритрита концентрированной азотной кислотой с последующей перекристаллизацией полученного тэна из ацетона.
Химизм получения и области применения тэна
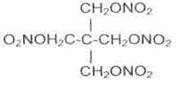
Пентаэритриттетранитрат (тэн) является азотнокислым, эфиром многоатомного спирта пентаэритрита. Впервые он был получен Толленсом в 1891 г. Из эфиров азотной кислоты это наиболее стойкое и сравнительно малочувствительное к механическим воздействиям взрывчатое вещество. Его формула:
Тэн является одним из мощных бризантных взрывчатых веществ, для производства которого имеется практически неограниченная сырьевая база, так как первичными материалами для его получения являются синтетические продукты. Развитие органического синтеза позволило удешевить производство исходных продуктов для приготовления пентаэритрита – формальдегида и ацетальдегида, что и явилось стимулом для возникновения производства тэна. Формальдегид в настоящее время готовится в больших количествах из синтетического метанола. Ацетальдегид получается из ацетилена путем каталитической гидратации его в присутствии ртутных солей.
Все же в настоящее время стоимость тэна еще высока, и поэтому в мирной промышленности он применяется главным образом в капсюлях-детонаторах и идет для приготовления детонирующего шнура. Тэновые капсюли обладают значительно большей инициирующей способностью, чем гремучертутные и азидотетриловые.
Вследствие высокой чувствительности к механическим воздействиям тэн в чистом виде для снаряжения боеприпасов не применяется [13].
Тэн, или пентаэритриттетранитрат, является сложным азотнокислым эфиром четырехатомного спирта пентаэритрита.
Сам пентаэритрит С(СН2ОН)4 получается конденсацией ацетальдегида и формальдегида в присутствии гидроксида кальция по реакции:
2СН3СHO+8НСHO+Са(ОН)2=2С(СН2ОН)4+(НСОО)2Са.
Пентаэритрит представляет собой белое кристаллическое вещество с температурой плавления 260°С, не имеющее запаха и сладковатое на вкус. Он довольно хорошо растворим в воде (при 15°С в 100 частях воды растворяется 5,55 части пентаэритрита) [19, с. 79].
Пентаэритрит, особенно технический, содержит значительное количество примесей. Основная примесь – дипентаэритрит – продукт конденсации двух молекул пентаэритрита:
2С(СН2ОН)4 →Н2О + С(СН2ОН)3 – СН2 – О – СН2 – С(СН2ОН)3.
Дипентаэритрит, присутствуя в пентаэритрите, снижает температуру плавления последнего, образуя с ним при известных соотношениях (70% пента- и 30% дипентаэритрита), эвтектическую смесь, плавящуюся при 100°С. Дипентаэритрит плавится при 221°С. Технический пентаэритрит с температурой плавления 235°С содержит 10% дипентаэритрита.
Второй неизбежной примесью пентаэритрита являются сахаристые вещества, которые образуются вследствие альдольной конденсации формальдегида в щелочной среде.
6НСНО → СН2ОН(СНОН)4 – СНО.
Содержание этих примесей доходит до 0,26%.
Третьей примесью являются смолы, придающие продукту желтоватую окраску.
Из неорганических примесей основной является известь, которая обусловливает зольность продукта до 0,25%.
Большое содержание окисляющихся и сахаристых веществ в пентаэритрите вызывает во время получения азотокислого эфира побочные реакции, результатом которых является повышение температуры. Внезапное сильное повышение температуры при этерификации пентаэритрита азотной кислотой может вызвать вспышку и даже взрыв, поэтому необходимо тщательно следить за тем, чтобы содержание подобных примесей не превосходило норм, предусмотренных техническими условиями.
Качество пентаэритрита влияет также на выход тэна. Из пентаэритрита с температурой плавления 210°С выход кристаллизованного тэна составляет около 80%, а с температурой плавления 238°С – около 92%.
Пентаэритрит, применяемый для получения тэна, должен иметь температуру плавления не ниже 240°С и при опытной этерификации давать выход тэна не менее 90% от теоретического.
Действием азотной кислоты пентаэритрит легко может быть превращен в эфир по реакции:
С(СН2ОН)4 + 4HNO3= C(CH2ONO2)4 + 4Н2О.
При этом концентрация кислоты не должна быть ниже 86% HNO3. С повышением концентрации исходной азотной кислоты выход продукта увеличивается. Модуль ванны берется таким, чтобы отработанная кислота содержала 80–82% HNO3. Уменьшение модуля ванны и концентрации исходной азотной кислоты приводит к интенсивным окислительным процессам.
На окислительные процессы также влияют температура реакции и окислы азота. Поэтому температура этерификации не должна быть выше 20°С, а содержание окислов азота в азотной кислоте не более 2%.
Процесс этерификации пентаэритрита экзотермичен и протекает с большой скоростью, поэтому для поддержания указанной температуры необходимо очень энергичное перемешивание, хорошее охлаждение и порциальное прибавление спирта в кислоту.
По другому способу тэн получают через сернокислый эфир с последующей переэтерификацией при 55–60°С добавлением азотной кислоты.
При действии серной кислоты на пентаэритрит образуется сложный эфир пентаэритритсульфат по реакции
С(CH2OH)4+xH2SО4=C(CH2OH)4-X(CH2OSO3H)x+xH2O,
где х равен двум или трем, т.е. при действии серной кислоты получается пентаэритритдисульфат или пентаэритриттрисульфат [18, с. 334].
Превращение этого продукта в эфир азотной кислоты производится концентрированной азотной кислотой или меланжем по уравнению
C(CH2OH)4-x(CH2OSO3H)x+4HNO3= С(CH2ONO2)4 + (4-x) H2O+xH2SO4
Переэтерификация пентаэритритди- или пентаэритриттрисульфата происходит труднее, чем этерификация пентаэритрита; если этерификация последнего азотной кислотой идет с довольно большой скоростью даже при 0°С, то переэтерификация первого начинается при 35–40°С, а с достаточной скоростью протекает только при 55–60°С.
Промежуточным продуктом переэтерификации пентаэритритди- или пентаэритриттрисульфата является пентаэритритдинитратдисульфат, который не полностью превращается в тэн, а частично в нем остается.
Смешанные эфиры нестойки и являются причиной низкой стойкости нестабилизованного тэна. Для получения стойкого тэна, свободного от смешанных эфиров, этерификацию пентаэритритдисульфата азотной кислотой проводят при повышенной температуре порядка 55–60°С. Однако для полного удаления нестойких примесей тэн необходимо подвергать специальной стабилизации – кипячению с раствором соды (содовой варке) и перекристаллизации.
Промытый водой тэн обрабатывают в течение часа кипящим раствором соды, затем, после фильтрования, растворяют в ацетоне. В полученный раствор добавляют углекислый аммоний для нейтрализации оставшихся в тэне минеральных и, вероятно, органических кислот. Раствор отфильтровывают от избытка (NH4)2CO3 а также от других механических примесей, и для выделения кристаллов тэна охлаждают или выливают струей в двух-трехкратное количество воды.
