Проблемы экстракорпорального оплодотворения
Оценка степени зрелости ооцитов по состоянию комплексов ооцит-cumulus, как правило, субъективна и часто не отвечает истинному состоянию ооцита. Асинхронность в созревании ядра ооцита, ооплазмы и клеток cumulus достаточно часто встречается в циклах стимуляции суперовуляции при ЭКО. Однако более точное определение степени зрелости (если клетки corona radiata и cumulus удаляют ферментативно или механически) может привести к травматизации ооцита и увеличению риска полиспермии при оплодотворении.
На рис.2 представлены данные по распределению ооцитов, полученных в ходе стимуляции суперовуляции, по степени зрелости. Оценка производилась после удаления клеток cumulus.
|
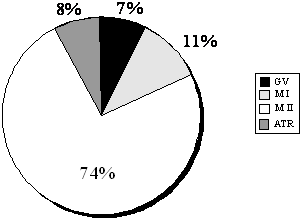
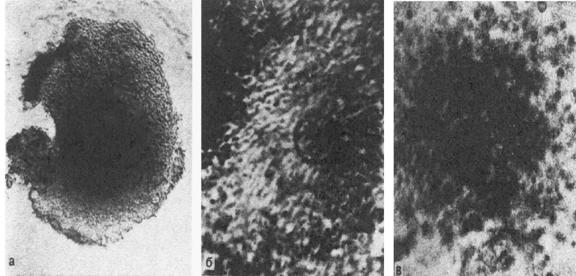
Рис.3. Ооцитарно-фолликулярные комплексы.
а – незрелый; б – зрелый; в – перезревающий. Микрофотографии живых объектов в фазовом контрасте.
ОБРАБОТКА СПЕРМЫ ПЕРЕД
ОПЛОДОТВОРЕНИЕМ ООЦИТОВ in vitro
Эякулят для ЭКО получают путем мастурбации в стерильный контейнер. После полного разжижения спермы, происходящего при комнатной температуре через 30 - 60 мин, приступают к ее обработке. Предварительно необходимо провести анализ концентрации сперматозоидов, их подвижности и морфологических характеристик по стандартной методике ВОЗ.
Перед тем как добавлять сперму в культуральную среду с ооцитами, необходимо ее обработать в целях удаления семенной плазмы и получения максимально полноценной фракции прогрессивно подвижных сперматозоидов. На практике применяются два основных метода обработки спермы - центрифугирование-флотация (процедура swim-up) и градиентное центрифугирование.
При использовании методики swim-up 1 – 2 мл спермы помещают в коническую 10 – 15-миллиметровую пробирку, добавляют 5 - 10 мл среды для отмывки* и центрифугируют 5 – 10 мин при ускорении 1200 g. Затем супернатант удаляют, осадок ресуспендируют в 2 – 3 мл среды и вновь центрифугируют. После удаления супернатанта 1 – 2 мл свежей среды осторожно наслаивают на осадок, пробирку помещают в CO2-инкубатор при 37°С на 30 – 60 мин. В течение этого времени подвижные сперматозоиды должны мигрировать в наслоенную среду, оставив на дне пробирки неподвижные сперматозоиды, дебрис и иные клетки. Если пробирки будут установлены наклонно, увеличится площадь контакта осадка со средой и, соответственно, выход подвижных сперматозоидов. Для определения концентрации и подвижности сперматозоидов в надосадочной жидкости берется аликвота 10 или 50 мкл. Затем необходимое количество чистого супернатанта используется для инсеминации.
Важным шагом вперед в методике обработки спермы стало внедрение метода центрифугирования в градиенте Перколла. Перколл представляет собой суспензию силиконовых гранул 15 – 30 нм в диаметре, покрытых слоем поливинилпирролидона (PVP), поскольку в чистом виде они токсичны для клеток. Особенностью Перколла является очень низкая осмолярность – 25 мОсм/л, поэтому при разведении в среде до различных концентраций, соответствующих различным плотностям (от 1,01 до 1,13 г/л), осмолярность растворов остается постоянной. Растворы Перколла (40 и 90%) готовятся из 100% раствора, представляющего собой смесь 9 частей Перколла и 1 части 10-кратно концентрированной среды для отмывки. Прерывистый градиент плотности достигается путем помещения 1,5 мл 40%-го Перколла на 1,5 мл 90%-го в конической пробирке; сверху аккуратно наслаивается сперма (1 – 2 мл), и вся эта трехслойная колонка центрифугируется 15 мин при ускорении 700 g. После центрифугирования в осадок попадают только функционально нормальные сперматозоиды; неподвижные и аномальные сперматозоиды, а также лейкоциты и другие клетки спермы задерживаются на границе 40 и 90%-q фракций. Осадок отбирается пастеровской пипеткой и два раза отмывается в специальной среде, как и в случае применения методики swim-up (см. выше).
Последний метод, по мнению многих авторов, является более предпочтительным, сочетая в себе хорошую сепарацию и высокий выход фертильных сперматозоидов. Кроме того, описано и защитное действие Перколла: он не позволяет попасть в осадок дефектным сперматозоидам, лейкоцитам и другим клеткам спермы, производящим большое количество свободных радикалов, способных повреждать мембраны сперматозоидов. Таким образом, чем более благоприятно соотношение жизнеспособных сперматозоидов и дефектных, тем меньше вероятность повреждений первых.
ОПЛОДОТВОРЕНИЕ ООЦИТОВ in vitro
Много споров и разночтений вызывает вопрос о времени введения сперматозоидов в среду, где культивируются ооциты. Наиболее общепринятым считается, что между выделением первого полярного тельца ооцита (достижением стадии М II) и добавлением спермы должно пройти около 4 ч, тогда способность такого ооцита к оплодотворению и последующему дроблению будет максимальной.
Преовуляторный фолликул на момент аспирации (обычно 36 ч после введения хорионического гонадотропина - ХГ, имитирующего пик эндогенного ЛГ в момент овуляции при естественном цикле), как правило, содержит ооцит на стадии М II. В естественных условиях овуляция, а значит, и возможность оплодотворения наступает через 38 - 40 ч после пика ЛГ.
На практике преинкубация ооцитов перед инсеминацией составляет от 2 до 6 ч. Данные по влиянию времени инкубации на оплодотворяемость ооцитов, дробление эмбрионов и беременность разноречивы. По данным К. Yanagida с соавт., исследовавших такую зависимость при инкубации ооцитов в течение 1 - 11 ч перед оплодотворением (применялся метод интрацитоплазматической микроинъекции сперматозоида в яйцеклетку - ИКСИ), способность ооцитов к оплодотворению, последующему дроблению и имплантации статистически достоверно снижается при инкубации их более 9 ч. Достоверных различий при инкубации в течение 1 - 9 ч не было обнаружено. В другом исследовании было показано, что инкубация более 9 ч перед оплодотворением наиболее оптимальна для последующего прохождения всех вышеуказанных процессов при ИКСИ; исследователи предполагают, что это связано с дозреванием цитоплазмы ооцита, необходимым для его активации при оплодотворении.
Важным моментом в обеих работах является то, что инкубация ооцитов происходила в присутствии клеток cumulus и corona radiata. Известно, что созревание ооцита полностью зависит от окружающих клеток фолликулярного эпителия, поставляющих в ооплазму РНК и белки, необходимые для развития будущего организма до включения его собственного генома, а также белковые факторы, отвечающие за процесс оплодотворения. Было показано, что дозревание ооцитов in Ditro со стадии GV до стадии МII при интактном cumulus происходило с большей вероятностью, причем последующее их оплодотворение и дробление было лучше.
