Разработка технологического процесса нанесения никель фосфорных покрытий на изделия из титана
Наиболее важными параметрами осаждения являются температура и рН раствора. Повышение температуры увеличивает скорость осаждения. Электролит может быть щелочным или кислым, но последний более предпочтителен.
Согласно современным представлениям, суммарный процесс химического никелирования включает в себя, по крайней мере три реакции:
![]()
![]()
![]()
Механизм процесса химического никелирования очень сложен. Согласно последним исследованиям [2], механизм реакции при химическом никелирования носит следующий характер.
Первой стадией процесса является реакция взаимодействия гипофосфита с водой. Эта реакция, протекающая на каталитической поверхности, заключается в замене водорода из связи Р — Н в молекуле гипофосфита на группу — ОН из воды. Реакция, описывающая это взаимодействие, выражается уравнением
![]() (3)
(3)
Образующиеся при реакции электрон и адсорбированньий атом водорода в условиях кислой и слабощелочной среды взаимодействуют с ионом водорода по реакции
![]()
Суммарная реакция взаимодействия гипофосфита с водой соответствует уравнению
![]() (4)
(4)
В условиях щелочной среды (рН> 9) образующиеся при окислении гипофосфита в фосфит электрон и атом водорода из связи Р — Н, взаимодействует с водой, приводят к молизации по типу электрохимической десорбции:
![]() (5)
(5)
Учитывая, что вторая константа диссоциации иона фосфита достаточно велика, можно полагать, что молизация водорода непосредственно связана с диссоциацией этого иона. В этом случае реакция химической десорбции может быть представлена уравнением
![]() (6)
(6)
Из уравнения (3) наглядно видно, что процесс окисления гипофосфита водой приводит к снижению рН раствора. Снижение рН раствора может оказаться и результатом непосредственной нейтрализации иона ![]() ионом
ионом ![]() .
.
При наличии в растворе ионов никеля электроны, образующиеся по реакции (3), восстанавливают их до металла:
![]()
Суммарную реакцию восстановления ионов никеля гипофосфитом можно представить в виде следующих уравнений:
![]() (7)
(7)
![]() (8)
(8)
При протекании реакций (7) и (8) могут также идти реакции (4) — (6), которые приводят к снижению коэффициента использования гипофосфита.
Одновременно с восстановлением никеля протекает реакция восстановления гипофосфита до элементарного фосфора. Реакция, приводящая к образованию фосфора, связана с разрывом связей Р— Н, Р—О и Р—ОН в молекуле гипофосфита. Протекание указанной реакции может быть представлено следующим уравнением:
![]() (9)
(9)
Суммарная реакция, включая и реакцию взаимодействия гипофосфита с водой, поставляющую электроны, выразится уравнением
![]() (10)
(10)
В соответствии с уравнением (9) экспериментально определяется установленная зависимость содержания фосфора в покрытиях от рН раствора, а именно: увеличение количества фосфора в осадке с уменьшением величины рН.
Процесс образования Ni—Р покрытий начинается самопроизвольно только на некоторых каталитически активных металлах, К их числу относятся никель, железо, кобальт, палладий и алюминий. Однако никелевое покрытие можно нанести и на другие металлы посредством дополнительной обработки поверхности.
Никель может быть осажден также восстановлением при помощи боранатов, таких как боранат натрия ![]() или N – диэтилборазан
или N – диэтилборазан ![]() . Основная реакция протекает по следую щей схеме:
. Основная реакция протекает по следую щей схеме:
![]() (11)
(11)
Ванна с раствором бораната натрия работает при рН=14 и температуре 90—95°С. Скорость осаждения составляет 10— 30 мкм/ч. Для протекания этой реакции требуется металлический катализатор.
Химическое восстановление в настоящее время широко используют для осаждения никеля в качестве первой стадии электроосаждения на пластинки, особенно такие, как акрилонитрил—бутадиен—стирол, и в меньшей степени полипропилен. Пластик сначала травят в сильной смеси хромовой и серной кислот, сенсибилизируют в растворе двухлористого олова, а затем активируют в палладиевой или серебряной ванне. После этого пластик готов к химическому никелированию.
За осаждением никеля химическим методом следует стадия электроосаждешя необходимого покрытия, чаще всего меди плюс никель и сверху хром.
При осаждении никеля путем восстановления без наложения ЭДС для технических целей используют соединения бора как восстановителя. Покрытия никель — бор имеют в основном такие же механические, физические и химические свойства, как покрытия никель — фосфор и поэтому последующие обсуждения свойств покрытий рассматриваются на примере покрытия типа никель — фосфор.
1.2.3.3. Влияние различных факторов на процесс нанесения покрытий.
Влияние рН растворов. Значительное влияние на процесс восстановления никеля оказывает кислотность раствора, что видно из результатов, приведенных на рис.1, при нанесения никель — фосфорного покрытия. При снижении рН до 6.0 — 6.5 скорость нанесения покрытия заметно возрастает, однако это значение рН в процессе восстановления никеля затруднено, так как в ходе процесса образуются трудно растворимые никелевые соединения в растворе — фосфиты никеля.
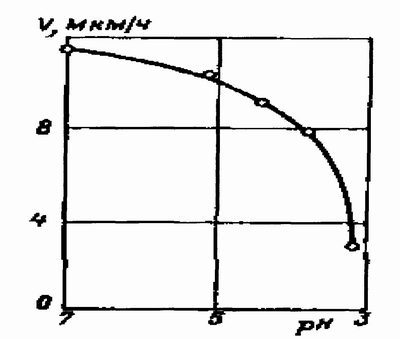
Рис. 1. Влияние рН на скорость образования покрытия [2].
Для предотвращения выпадения осадка в раствор вводят комплексообразователи: этилдиамин, уксусная кислота, лимонная, гликолевая кислота и др.
Основным же недостатком щелочных ванн является их неустойчивость, связанная с летучестью аммиака при нагревании раствора.
Кислые растворы (рН 4.0 — 0.5) применяют для нанесения покрытий на детали из черных и некоторых цветных металлов (медь, латунь и др.) особенно когда их рабочие поверхности должны иметь высокую твердость, износостойкость и корозионно — защитные свойства.
С течением времени скорость никелирования в некорректируемых кислых растворах постепенно уменьшается и через б ч работы процесс образования покрытий почти прекращается.
