Технология нуклеофильного замещения функциональных групп в органических соединениях
 (20)
(20)
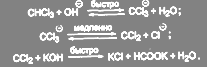
Дихлоркарбен является очень реакционноспособным соединением. Его промежуточным образованием объясняется целый ряд реакций. Так, например, пятичленные гетероциклы (индол, фуран, тиофен, а также их производные) присоединяют дихлоркарбен с последующей перегруппировкой и ароматизацией полученного продукта, превращаясь в соответствующие 3-хлорзамещенные шестичленные гетероциклические соединения:
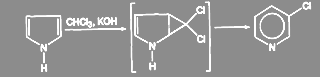
Аналогичные реакции присоединения дихлоркарбена известны в ряду сопряженных олефинов, например у циклопентадиена:
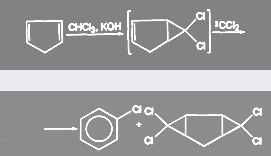
При гидролизе ССl4 образуется фосген:
![]() (24)
(24)
При омылении дигалогенидов не следует применять гидроксиды щелочных металлов, так как образующиеся карбонильные соединения чувствительны к сильнощелочной среде. Омыление проводят в присутствии карбоната кальция или калия, ацетата натрия, формиата или оксалата.
Бензилиденхлориды и бензилиденбромиды гладко гидролизуются до бензалдегидов под действием концентрированной серной слоты. Электронодонорные группы в ядре облегчают гидролиз, электроноакцепторные — затрудняют. В последнем случае следует повысить температуру акции до 120—130 °С (но не выше, т. к. при более высокой температуре альдегиды будут интенсивно окисляться серной кислотой).
Галогениды с повышенной реакционной способностью гидролизуются очень легко. Так, аллилхлорид и бензилхлорид превращаются в аллиловый и бензиловый спирт при кипячении в избытке воды. В зависимости от структуры субстрата и условий проведения реакции могут протекать вторичные процессы. Так, в синтезе мезатона при щелочном гидролизе м-нитрофенилбромметилкарбинола образуется окись м-нитростирола:
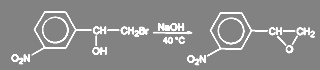 (25)
(25)
Аналогичная реакция имеет место в синтезе левомицетина:
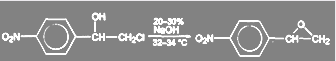 (26)
(26)
При образовании п-нитро-α-метоксистирола в спиртовой щелочи проходит реакция элиминирования:
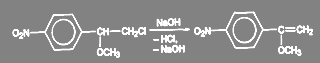 (27)
(27)
При получении оригинального отечественного противоопухолевого препарата допан замену галогена в гетероароматическом ядре проводят при кипячении с соляной кислотой. Следует обратить внимание на то, что хлор в хлорэтильных группах при этом не обменивается. Выход очищенного продукта 85—86%.
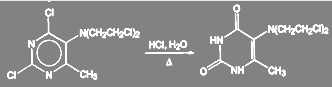 (28)
(28)
Значительно чаще в синтезе лекарственных препаратов используется нуклеофильная замена атома галогена на ОАIk-группу. Реакцию проводят либо со спиртом в щелочной среде, либо с алкоголятом.
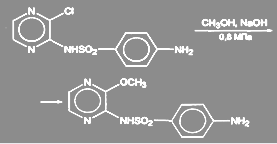
Реакция обычно требует активированных субстратов, в противном случае выход целевого продукта (эфира) может оказаться низким за счет побочных процессов. В случае фенольных нуклеофилов (АгОН) реакция катализируется солями меди, в присутствии которых нет необходимости в наличии активирующих групп. Считают, что в этом случае реакция идет за счет активных реагентов АгОСu. Выходы эфиров по этому методу обычно высокие. Более того, в качестве нуклеофилов иногда используют соли кислот RСООН. При обработке арилгалогенидов бензоатом меди (I) в диглиме или ксилоле при температуре от 140 до 160 °С с высокими выходами получают арилбензоаты. При получении сульфапиридазина 3-хлор-6-сульфаниламидопиридазин нагревают 9 ч при 130 ºС и давлении 0,7—0,8 МПа с большим избытком едкого кали в среде метанола:
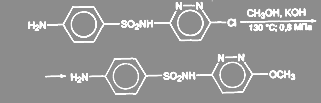 (29)
(29)
Аналогично идет процесс в синтезе сульфалена:
 (30)
(30)
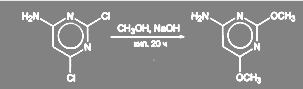
В синтезе сульфадиметоксина замена хлора в 4-амино-2,6-дихлорпиримвдине происходит при 20-часовом кипячении в метанольном растворе NаОН:
 (31)
(31)
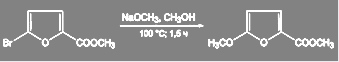
В ряду пятичленных гетероароматических соединений такие реакции проводят лишь при активации галогена электроноакцепторными заместителями:
 (32)
(32)
Реакция получения простых эфиров по Вильямсону является одним из примеров успешного применения метода межфазного катализа для синтеза органических соединений. В условиях МФК она дает более высокие выходы продуктов, протекает с большей скоростью и является более простой в техническом исполнении. В большинстве случаев при проведении процессов традиционным методом необходимо предварительно получить алкоголят, что требует использования таких сильных оснований, как металлический натрий, амид натрия, а также предварительного обезвоживания реагентов и растворителей.[5]
В двухфазном синтезе простых эфиров в качестве основания используется концентрированный водный раствор едкого натра (обычно 50%). Спирт в растворе депротонируется по действием гидроксил-аниона вводной фазе или на границе раздела фаз. Растворение аниона алкоголята в органической фазе происходит за счет образования ионной пары с липофильным катионом межфазного катализатора (чаще всего четвертичной соли аммония). Тот факт, что в органическую фазу переходит алкоголят тетраалкиламмония, а не его гидроксид, объясняется тем, что ОН- более эффективно сольватируется водой, чем алкоголят-анион и предпочтительно остается в водной фазе.
Наблюдаемое повышение скорости образования простого эфира объясняется несколькими факторами. Главная компонента энергетического барьера в реакциях SN 2 — удаление молекул растворителя от нуклеофила. В традиционном способе (в гомогенных условиях) десольватация аниона нуклеофила затруднена, особенно в протонньихрастворителях. В условиях МФК анион в виде ионной пары с большим липофильным катионом аммонийной соли катализатора в неполярной органической фазе сольватирован мало. Вторым важным преимуществом МФК является то, что реакционная способность алкоголят-аниона, связанного с большим по размерам катионом МФ-катализатора, оказывается выше, чем у аналогичного иона в алкоголяте калия или натрия.[7]
Приведем несколько примеров успешных опытов получения простых эфиров в условиях МФК:
 (33)
(33)
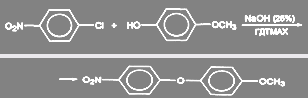
Известно несколько примеров аналогичных подходов в синтезах диариловых эфиров. Так, введение в качестве катализатора хлорида гексадецилтриметиламмония (ГДТМАХ) в реакцию п-нитрохлорбензола с п-метоксифенолом в присутствии 25% раствора КОН повышает выход эфира с 67% до 98%:
Если вместо гидроксил- или алкоголят-аниона взять гидросульфид-меркаптяд-ионы, то образуются соответствующие арилтиолы и тиоэфиры.
![]() (36)
(36)
Активированные арилгалогениды обычно дают хорошие выходы, но в ряде случаев побочные реакции являются конкурентными. Под действием SАг- можно получить диарилсульфиды. В реакцию с SАг- вступают даже неактивированные арил- и алкилгалогениды, если проводить ее в полярных апротонных растворителях (диметилформамид, диметилсульфоксид) Диарилсульфиды получаются с высокими выходами при обработке неактивированных арилиодидов SАг- в жидком аммиаке. Реакции с галогеналкилами обычно проводятся в среде этанола:
