Технология нуклеофильного замещения функциональных групп в органических соединениях
Нитрилы являются важными промежуточными продуктами в синтезе многих химико-фармацевтических препаратов, так как легко превращаются в амиды карбоновых кислот, карбоновые кислоты, амины:
![]() (55)
(55)
Как сам бензилцианид, так и получающиеся из него фенилуксусная кислота и -фенилэтиламин широко используются в синтезе биологически активных соединений.
Из монохлоруксусной кислоты можно получить циануксусную кислоту (для синтеза теобромина, теофиллина, кофеина и др.) и используемую во многих синтезах малоновую кислоту:
![]() (56)
(56)
Замещенные бензилцианиды также широко используются для синтеза лекарственных веществ:
 (57)
(57)
При синтезе папаверина З,4-диметоксифенилацетонитрил получают так называемым цианметилированием вератрола. Реакция, вероятно, идет как минимум в две стадии: на первой стадии образуется 3,4-диметоксибензилхлорид, который под действием цианида натрия превращается в нитрил:
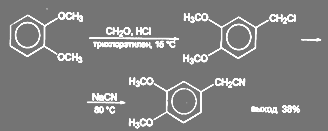 (58)
(58)
В ряду пятичленных гетероароматических соединений реакция идет в довольно жестких условиях:
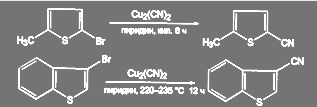 (59)
(59)
Галоген в пиридиновом ядре достаточно подвижен, что может быть использовано, в частности, при синтезе никотиновой кислоты:
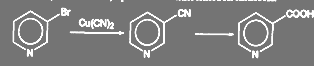 (60)
(60)
Замещение галогена на цианид-ион — это одна из первых реакций, в которых нашел применение межфазный катализ.
Установлено, что реакция нуклеофильного замещения происходит в органической фазе и эта бимолекулярная стадия определяет скорость всего процесса. Реакция идет быстрее с первичными, чем со вторичными алкилгалогенидами. В случае вторичных алкилгалогенидов с реакцией замещения конкурирует процесс элиминирования.[18]
Реакция с цианид-ионом в условиях МФК идет часто даже лучше, чем в диполярных апротонных растворителях. Например, из втор-хлороктана в условиях МФК образуется 85—90% продуктов замещения и 10—15% продуктов элиминирования, в то время как в гомогенной среде в диметилсульфоксиде образуется только 70% втор-цианооктана. Помимо четвертичных ониевых солей при цианировании в качестве катализаторов успешно применены краун-эфиры и криптаты.
Преимущества проведения реакции цианирования в условиях МФК хорошо иллюстрируются на примере производства цианистого бензила, важного полупродукта в синтезе целого ряда лекарственных препаратов.
![]() (61)
(61)
По традиционной технологии указанную реакцию проводили в 75% водном этаноле при 76—78 °С. Выход цианистого бензила составлял 77— 79% (в расчете на хлористый бензил). Помимо основного продукта в реакпии образовывались примеси бензиламина, бензилового спирта, бензилового эфира, фенилуксусной кислоты и других веществ, что затрудняло отделение и очистку целевого продукта.[17]
Проведение процесса цианирования хлористого бензила в двухфазной системе С6Н5СН2СI — водный раствор NаСN позволило увеличить выход продукта реакции до 95—96%. В качестве катализаторов процесса в настоящее время используют бензилтриэтиламмоний хлорид или бензилдиметилформвламмоний хлорид, которые образуются непосредственно в реакционной массе, при добавлении триэтиламина или диметилформамида (около 0,5% мольн.):
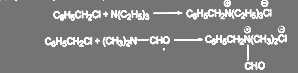 (62)
(62)
В двухфазной системе в мягких условиях проведено цианирование ряда арилгалогенидов. Однако для этих соединений наряду с межфазными катализаторами (четвертичными аммониевыми солями и краун-эфирами) требуется вводить сокатализаторы. В качестве последних используются комплексы никеля и солей палладия с арил- или алкилфосфинами.
Важной реакцией, использующейся при синтезе лекарственных веществ, является реакция между сульфитом щелочного металла и органическим галогенидом (реакция Штреккера):
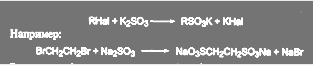 (63)
(63)
Выходы сульфокислот составляют 70-90 % при использовании первичных алкилгалогенидов 20-25% для вторичных. Третичные алкилгалогениды превращаются в олефины. В реакцию вступают также галогензамещённые кислоты, спирты, кетоны и ароматические соединения с подвижным галогеном:
 (64)
(64)
2. Нуклеиновое замещение сульфогруппы
2.1 Общие сведения о процессе
Нуклеиновое вытеснение сульфогруппы является важнейшим способом синтеза гидрокси- и аминосоединений в ароматическом ряду. Особенно часто эта реакция используется для промышленного получения гидрокси соединений. Поскольку процесс обычно поводят при взаимодействии со щёлочью при высокой температуре, то он известен так же известен под названием щелочного плавления.
Реакция идёт в соответствии со схемой:
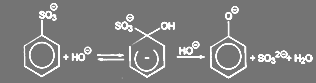 (65)
(65)
В зависимости от соотношения констант скоростей первой и второй стадии процесса реакция идет по второму (первый по гидроксилу) или третьему (второй по гидроксилу) порядку. Энергия активации велика и составляет 145—200 ж/моль при 300—340 ºС.[20]
Обычно для щелочного плавления применяют растворы сульфокислот или их пасты, получающиеся при выделении солей сульфокислот. В качестве щелочи обычно используют едкий натр. Едкое кали как более дорогое сырье используют лишь в тех случаях, когда едкий натр оказывается недостаточно реакционноспособным. В некоторых случаях используют смесь едкого натра и едкого кали. Такая смесь имеет более низкую температуру плавления, чем каждая из взятых щелочей. Взаимодействие протекает по уравнению:
![]() (66)
(66)
Наличие в технической щелочи значительных примесей минеральных солей приводит к образованию в плаве комков, затрудняющих перемешивание и значительно ухудшающих качество продукта вследствие местных перегревов реакционной массы. Содержание в щелочи минеральных солей поэтому не должно превышать 10%. Примесь хлората натрия в щелочи недопустима, так как она может вызывать возгорание плава.[4]
Щелочное плавление в промышленности осуществляется тремя способами:
1 Открытое щелочное плавление, т. е. сплавление пасты натриевой или калиевой соли сульфокислоты со щелочью или ее концентрированным раствором при атмосферном давлении;
2 Автоклавное щелочное плавление проводится под давлением в автоклавах. В этом случае используют водные растворы солей сульфокислот. Метод применяется в тех случаях, когда нужно заместить гидроксилом лишь одну из нескольких сульфогрупп, имеющихся в молекуле исходного соединений. Этот метод используют также при щелочном плавлении аминосульфокислот, так как при проведении этого процесса открытым способом аминогруппа также замещается гидроксигруппой. Практически на каждый моль сульфосоли загружают не 2, а от 2,1 до 3,5 молей щелочи;
