Физико-химические основы адсорбционной очистки воды от органических веществ
Теория полимолекулярной сорбции, в основе которой лежит представление о многослойной сорбции на поверхности макро- и мезопористого сорбента, была разработана Брунауэром, Эметом и Теллером. Однако в практике наибольшее распространение получили микропористые сорбенты, в чрезвычайно малом пространстве микропор которых послойной сорбции вещества на поверхности не происходит. При сорбции в микропорах происходит заполнение части или всего объема их сорбатом, который под действием взаимно усиливающихся и перекрывающихся адсорбционных полей, создаваемых противоположными стенками пор, находится в специфическом уплотненном состоянии. Теории объемного заполнения микропор, разработанная Дубининым и его школой, использует понятие о предельном объеме адсорбционного пространства микропористого сорбента W0. Основное уравнение адсорбции паров и газов на микропористых сорбентах, известное как уравнение Дубинина – Радушкевича, имеет вид:
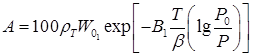 (2)
(2)
При сорбции вещества из раствора оно занимает на поверхности или в объеме пор сорбента место, которое до этого занимали молекулы растворителя (воды), а не свободное пространство. Присутствие воды в порах приводит к некоторому выравниванию сорбционного потенциала. В объеме сорбируемой фазы концентрация вещества значительно выше, чем в растворе. При этом снижается поверхностное натяжение на границе раздела раствор – твердый сорбент.
Основы термодинамики адсорбции из растворов впервые сформулировал Гиббс более 100 лет назад. Им было введено понятия избыточной адсорбции ![]() , т.е. избыточного содержания поглощаемого вещества в адсорбированной фазе по сравнению с его содержанием в растворе. Величина избыточной (гиббсовской) адсорбции легко определима по формуле
, т.е. избыточного содержания поглощаемого вещества в адсорбированной фазе по сравнению с его содержанием в растворе. Величина избыточной (гиббсовской) адсорбции легко определима по формуле
![]() (3)
(3)
где С0 и Ск – концентрация вещества в растворе до и после опыта; V – объем раствора; m – навеска сорбента.
Термодинамический подход к решению проблемы сорбции является наиболее общим и позволяет оценивать сорбируемость молекул по значению максимальной работы переноса вещества из раствора на поверхность сорбента. Поскольку при сорбции вещества из воды происходит уменьшение свободной энергии системы ![]() , Когановский предложил использовать эту величину для прогнозирования эффективности извлечения растворенных соединений из воды. Константа равновесия при сорбции из разбавленных растворов
, Когановский предложил использовать эту величину для прогнозирования эффективности извлечения растворенных соединений из воды. Константа равновесия при сорбции из разбавленных растворов ![]() связана с
связана с ![]() зависимостью вида
зависимостью вида ![]() , из которой следует, что чем больше
, из которой следует, что чем больше ![]() , тем лучше сорбируется вещество.
, тем лучше сорбируется вещество.
Идею о возможности применения теории объемного заполнения микропор для описания сорбции из жидкой фазы выдвинули Эльтеков и Стадник. Эта идея использует представления об отсутствии влияния физического состояния сорбата в объемной фазе на сорбционный потенциал в микропорах углей и отсутствии ассоциативных, ионных и водородных связей между молекулами сорбируемого вещества и воды, а также внутри сорбата. Эта теория применима для расчета сорбции из очень разбавленных растворов ограничено растворимых веществ: уравнение изотермы сорбции на микропористых АУ в данном случае принимает вид:
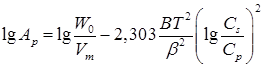 (4)
(4)
Здесь W0 – предельный объем микропор сорбента; Vm – мольный объем сорбата; ![]() – структурно-энергетическая константа;
– структурно-энергетическая константа; ![]() – растворимость соединения в воде при данной температуре;
– растворимость соединения в воде при данной температуре; ![]() – равновесная концентрация в воде.
– равновесная концентрация в воде.
Обобщая данные о сорбируемости на АУ низкомолекулярных органических соединений, можно сделать вывод, что менее других сорбируются структурно простые вещества в ионной форме, лучше – в молекулярной. Сорбируемость органических веществ возрастает в ряду:
гликоли < спирты < кетоны < сложные эфиры < альдегиды <
< недиссоциированные кислоты < ароматические соединения.
Вода, сорбируясь на участках окисленной поверхности АУ, препятствует сорбции на них неполярных алифатических соединений. Сорбируемость органических веществ возрастает с увеличением длины углеродной цепи (если она не ограничена размером пор сорбента), причем для гомологов, согласно правилу Траубе, на величину, кратную изменению длины углеродной цепи.
Способность к сорбции возрастает с ростом молекулярной массы органических веществ, особенно выше 30 000. Аналогична и зависимость при росте мицеллярной массы коллоидов. Присутствие в воде неорганических солей, способствующих укрупнению ассоциатов молекул красителей и гуматов, приводит к их более полному сорбционному выделению.
Специфическими загрязнениями сточных вод заводов СК являются неокисляемые биохимическими путем лейканол и трилон Б. Первый обладает свойствами ПАВ и присутствует в воде в виде отдельных молекул и ассоциатов, что и определяет особенность сорбции его из воды, а именно: при 20–30ºС отдельные молекулы и ассоциаты малых размеров сорбируются на ГАУ, а крупные ассоциаты способны лишь к дальнейшему укрупнению и коагуляции. Поэтому сорбционная емкость ГАУ зависит от начальной концентрации лейканола в воде, так как пропорционально росту ![]() увеличивается и доля крупных ассоциатов лейканола.
увеличивается и доля крупных ассоциатов лейканола.
Эффективность сорбции трилона Б на БАУ, ОУ, АГ-3, СКТ при ![]() ммоль/дм3 почти одинакова. Сорбция трилона Б из воды – типичный случай полимолекулярного поглощения с преобладающим взаимодействием во втором и последующих слоях над взаимодействием в первом слое.
ммоль/дм3 почти одинакова. Сорбция трилона Б из воды – типичный случай полимолекулярного поглощения с преобладающим взаимодействием во втором и последующих слоях над взаимодействием в первом слое.
Применение угля СКТ более эффективно в области малых равновесных концентраций (![]() ммоль/дм3); при больших
ммоль/дм3); при больших ![]() целесообразнее сорбция на АГ-3.
целесообразнее сорбция на АГ-3.
Такие биологические объекты, как бактерии и вирусы, несмотря на крупные размеры, хорошо сорбируются АУ. Изотерма сорбции E. Coli описывается уравнением Лэнгмюра, а вируса Polio – уравнением Фрейндлиха.
Влияние температуры на сорбцию из водных растворов далеко не однозначно. Дело в том, что при сорбции на микропористых сорбентах веществ, размеры молекул которых близки к эффективным размерам пор, проникновение этих молекул в поры зависит от их кинетической энергии. При достаточной энергии (температуре) молекулы сорбата проникают в окна пор и сорбируются; в противном случае происходит лишь незначительно поглощение на поверхности мезо- и макропор. Иными словами, сорбционная емкость повышается с ростом температуры; это явление получило название «активированной адсорбции». В то же время физическая сорбция, как любой экзотермический процесс, в целом ухудшается с ростом температуры. Поэтому суммарное внешне фиксируемое проявление этих двух явлений (активированной и физической адсорбции) может иметь экстремум при определенной температуре. Как показано в работах Дубинина, для газов и паров этот экстремум имеет вид острого пика.
