Мембранная энзимология
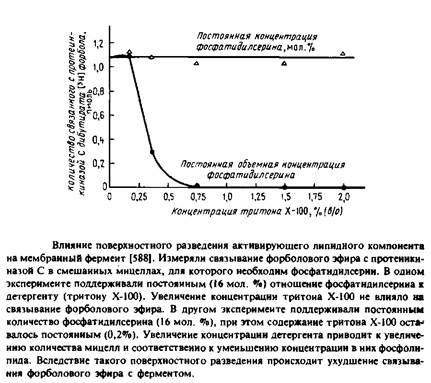
6.3 Другие примеры
Лимитирующей стадией биосинтеза фосфатидилхолина является синтез интермедиата CDP-холина. Фермент, катализирующий эту реакцию, называется СОР: фосфохолин цитидилтрансферазой. Он содержится в цитозоле, но, как было недавно показано, может связываться с эндоплазматическим ретикулумом, где происходит его активация. Именно в месте связывания осуществляется биосинтез фосфатидилхолина. Отметим, что оба субстрата растворимы в воде и не связаны с мембраной. Что заставляет фермент связываться с мембраной, пока неясно. Возможно, сигналом служит появление в мембране диацилглицеролов. Рассматриваются также следующие механизмы:
1) увеличение содержания длинноцепочечных жирных кислот или ацильных производных СоА;
2) истощение микросомной мембраны по фосфатидилхолину;
3) дефосфорилирование самого фермента, в результате чего он переходит в мембраносвязанную активную конформацию. Для установления истинного механизма необходимы дальнейшие исследования.
Показано, что в зависимости от содержания мембраносвязанных диацилглицеролов фермент диацилглицеролкиназа может перемещаться из цитозоля в мембрану. Он катализирует превращение диацилглицерола в фосфатидную кислоту и по крайней мере частично ответствен за утилизацию диацилглицерола в мембране. Диацилглицерол и жирные кислоты участвуют также в связывании а-актинина с мембранами. Полагают, что определенную роль в прикреплении пучков микрофиламентов к плазматической мембране играет и диацилглицеролкиназа. Возможно, индуцируемое диацилглицеролом и жирными кислотами образование комплексов а-актинина и актина является важным элементом физиологической активности тромбоцитов.
Остановимся вкратце еще на двух ферментах, которые в определенных условиях связываются с биомембранами: пируватоксидазе и фосфатидилсеринсинтетазе из Е. coli. В присутствии субстрата оба фермента перемещаются из цитозоля в цитоплазматическую мембрану. Пируватоксидаза уже упоминалась как пример липидзависимого фермента. В присутствии пирувата, восстанавливающего связанный с белком флавиновый кофактор, фермент по своим свойствам становится классическим мембранным белком. Он восстанавливает растворенный в мембране убихинон и поэтому для своего функционирования должен быть связан с мембраной. В норме при очистке фосфатидилсеринсинтазы она выделяется в связанном с рибосомами виде, но в присутствии либо субстрата, либо продукта оказывается связанной с мембраной.
6.4 Растворимые ферменты или ферментные ансамбли, которые in vivo могут быть ассоциированы с мембраной
В литературе все чаще появляются данные о возможной ассоциации целого ряда растворимых ферментов с мембраной. Большинство работ посвящено связыванию ферментов цикла трикарбоновых кислот и /3-окисления жирных кислот с внутренней митохондриальной мембраной и ферментов гликолиза с плазматической мембраной эритроцитов. Приводятся доказательства, хотя и не вполне убедительные, что ферменты митохондриального матрикса организованы в связанные с поверхностью мембраны мультиферментные комплексы. В некоторых случаях удалось выявить специфические центры связывания. Например, NAD + - зависимые дегидрогеназы образуют комплексы с NADH: убихинон оксидоредуктазой. Креатинфосфокиназа специфически связывается с кардиолипином во внутренней митохондриальной мембране; гексокиназа также связывается с митохондриями - возможно, с их наружной мембраной. Распределение гексокиназы между растворенной и связанной с митохондриями формами, по-видимому, модулируется гормонами или метаболитами. Во всех этих случаях смысл ассоциации перечисленных ферментов, а возможно, и других растворимых ферментов с мембраной, состоит в "канализации" субстрата. Например, переносимый через внутреннюю митохондриальную мембрану АТР должен более эффективно утилизироваться гексокиназой, локализованной около мембраны. Однако это предположение пока нельзя считать окончательно доказанным.
В ряде работ показано, что гликолитические ферменты связываются с экспонированным в цитоплазму кислым доменом белка полосы 3 мембраны эритроцитов. В число этих ферментов входят альдолаза, фосфофруктокиназа, глицеральдегид-3-фосфатдегидрогеназа. Предполагается, что в некоторых случаях связанный с мембраной фермент может оставаться в неактивной форме и быстро переходить в активную цитоплазматическую форму в присутствии соответствующих метаболитов. Пока неясно, правда, происходит ли такая ассоциация in vivo или это артефакт, связанный с работой in vitro. Взаимодействия между белками в таких ассоциатах относительно слабые и зависят от ионной силы. Такая же картина характерна для некоторых предполагаемых ассоциатов ферментов с митохондриальной мембраной. Однако сопряжение гликолитических функций с мембранными активностями и компартментализация этих ферментов, вообще говоря, слишком привлекательная концепция, чтобы ее отбрасывать, тем более что для других систем существование таких ассоциатов доказано.
Получить убедительные доказательства физиологической значимости взаимодействия этих ферментов и ферментных ансамблей с мембраной довольно трудно, но есть основания полагать, что в недалеком будущем в этой области исследований будет достигнут определенный прогресс.
Еще один класс взаимодействующих с мембраной растворимых белков представляют цитотоксины.
6.5 Факторы свертывания крови - внеклеточные ферменты, активируемые связыванием с мембраной
Свертывание крови происходит в результате сложного каскада реакций с участием целого ряда факторов сыворотки. В ходе этих реакций осуществляется последовательная протеолитическая активация серии зимогенов, каждый из которых, активировавшись, в свою очередь вызывает активацию одного или нескольких других зимогенов. Конечным результатом всех этих реакций является превращение фибриногена в фибрин. Для осуществления многих этапов этого каскада необходимо, чтобы активированная протеаза и/или субстрат-зимоген связалась с мембраной тромбоцитов, эндотелиальных или иных клеток. Особый интерес представляют следующие вопросы:
1) как белки связываются с мембранами? 2) какую роль играет мембрана в активации участвующих в свертывании крови ферментов? Окончательных ответов на эти вопросы пока нет.
Всем связывающимся с мембранами факторам свертывания крови необходимы кислые фосфолипиды. Некоторые из них, в частности факторы VII, IX, X и протромбин, требуют также Са2+. С участием витамина К происходит модификация этих четырех белков - карбоксилирование в ^-положении остатков глутамата, локализованных в гомологичных N-концевых участках каждого из полипептидов. В результате такой модификации в молекуле белка формируется значительное число высокоаффинных центров связывания Са2 +, который в свою очередь необходим для соответствующего взаимодействия белков с кислыми фосфолипидами на мембране. Каким образом Са2+ облегчает белково-мембранные взаимодействия, не совсем ясно. Это может быть, в частности, "сшивание" с помощью Са2+ белка с гидрофильными отрицательно заряженными головками фосфолипида. Кальций необходим не для всех факторов свертывания крови. Так, фактор V может непосредственно взаимодействовать с отрицательно заряженными фосфолипидами, а другой компонент, так называемый "тканевый фактор", вообще является интегральным мембранным белком. Большей частью, однако, факторы взаимодействуют с поверхностью бислоя за счет электростатических сил, хотя иногда наблюдается и некоторое проникновение белка в гидрофобную область мембраны.
