Мембранная энзимология
В мембране саркоплазматического ретикулума фермент, по-видимому, образует димеры, но мономерная форма в мицеллах детергента сохраняет основные кинетические свойства. С помощью процедуры дезоксихолатного диализа очищенная Са2 + - АТРаза может быть успешно встроена в везикулы. В некоторых препаратах реконструированный фермент образует более крупные агрегаты, чем димеры, хотя физиологическое значение этого процесса неясно.
В ряде лабораторий изолированный фермент был полностью обезжирен и реконструирован с целым рядом липидов и липидных смесей. На Рис.6.3 представлена зависимость активности АТРазы от количества связанного с ферментом липида в отсутствие детергентов. Из приведенных данных видно, что для полной активации на одну молекулу АТРазы должно приходиться 30 молекул фосфолипида; этого количества, по оценкам, достаточно, чтобы образовать вокруг каждой молекулы белка фосфолипидный монослой. Столь прямолинейная интерпретация этих данных, по-видимому, неправомочна, поскольку нам неизвестно физическое состояние такой смеси.
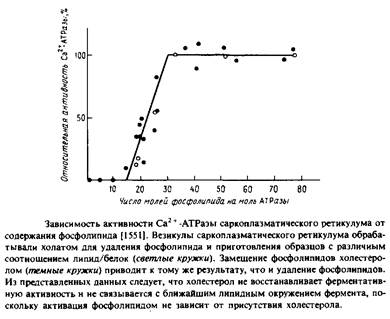
На основании результатов этой работы была предложена концепция пограничных, или аннулярных, липидов, т.е. липидов, непосредственно граничащих с белком. Критическим фактором, определяющим ферментативную активность, согласно этой концепции, должен быть липидный состав этого аннулярного слоя. Отсутствие влияния холестерола, включенного в фосфолипидно-белковые комплексы, предполагает, что холестерол не включается в аннулярный слой, однако соответствующие данные по связыванию холестерола показали, что это не так. Вообще говоря, на основании одних лишь кинетических данных понять механизм связывания липида довольно трудно.
В нескольких работах было достоверно доказано, что выше температуры фазового перехода липида отсутствует корреляция между вязкостью или параметром упорядоченности бислоя и ферментативной активностью. В регуляции ферментативной активности более важную роль, безусловно, играет структура самого липида, чем любой отдельно взятый параметр, отражающий физическое состояние бислоя. Но почему одни липиды активируют встроенные в везикулы ферменты лучше, чем другие, пока неизвестно.
4.4 Na+/K+ATPA3a
Этот фермент катализирует АТР-зависимый транспорт ионов Na+ и К+ через плазматическую мембрану животных клеток. На каждую молекулу гидролизованного АТР из клетки выводятся три иона Na + и поступают два иона К +. Фермент является электрогенным ионным насосом, генерирующим трансмембранный потенциал. Na +/К +-АТРаза выделена в чистом виде из нескольких источников. Она всегда состоит из двух суъединиц: большой каталитической субъединицы и малой, представляющей собой гликопротеин. Функция /3-субъ-единицы неясна. Полные аминокислотные последовательности обеих субъединиц известны для Na+/К+-АТРазы из почек овцы и из электрического органа ската Torpedo californica. Каталитическая субъединица гомологична Са + - АТРазе и также образует значительное число трансмембранных спиральных участков. /З-Субъединица, по-видимому, также пересекает мембрану; вероятно, трансмембранным является и единственный спиральный сегмент.
Функционирующей формой фермента, по-видимому, является либо гетеродимер а/3, либо тетрамер г; исследователи пока не пришли к единому мнению относительно минимальной единицы, необходимой для ионного транспорта. Очищенный фермент удается реконструировать с целым рядом фосфолипидов, но для восстановления активности наиболее эффективны фосфатидилсерин и фосфатидилглицерол. Причина этого неясна, но показано также, что фермент в бислое несколько лучше связывается с кислыми фосфолипидами. Липидное окружение влияет не только на каталитическую активность, но и на чувствительность фермента к специфическому ингибитору уабаину.
Для реконструкции Na+ /К + - АТРазы в первую очередь важна структура полярных головок фосфолипидов, но определенную роль, по-видимому, играет и вязкость бислоя. Об этом свидетельствуют результаты экспериментов по изменению с увеличением гидростатического давления вязкости липидов в содержащих фермент препаратах плазматической мембраны. Высокое давление стабилизирует систему в конфигурации с минимальным объемом. Поэтому с увеличением гидростатического давления свободный объем и вязкость бислоя уменьшаются. Как видно из рис, 6.4, между ферментативной активностью и вязкостью мембраны, измеряемой по степени анизотропии флуоресценции мембранных зондов, наблюдается четкая корреляция. Авторы полагают, что изменение свойств бислоя при повышении давления приводит к стабилизации определенных конформационных состояний фермента в ходе каталитического цикла, что влияет на лимитирующую стадию суммарной реакции.
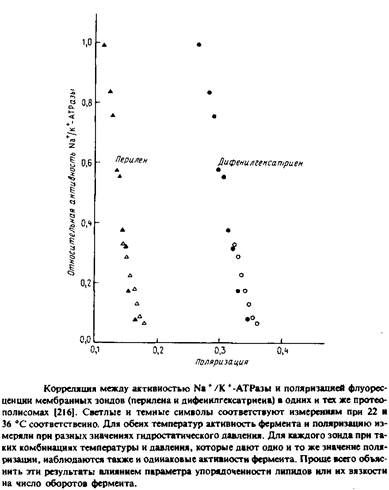
Нельзя, однако, исключить и иное объяснение: давление влияет на фермент прямо, а не опосредованно через липид. Впрочем, эти эксперименты важны уже тем, что показывают возможность изменения физического состояния мембраны под действием гидростатического давления.
4.5 Переносчик глюкозы
Поразителен, однако, тот факт, что на максимальную скорость работы этого переносчика вообще не влияет температурный фазовый переход липида из жидкокристаллического состояния в гель.
5. Мембраносвязанные электротранспортные цепи
В большинстве работ, посвященных мембранным ферментам, исследовались компоненты различных мембранных систем электронного транспорта. Эти системы выполняют весьма важные биохимические функции, а их компоненты содержат окрашенные простетические группы, что позволяет следить с помощью спектрофотометрического метода за кинетикой их редокс- или конформационных превращений как в нативной мембране, так и после выделения и очистки отдельных ферментов. Здесь мы рассмотрим четыре основные злектронтранспортные системы, схематически изображенные на рис. 5. Это:
1) участвующая в биосинтезе стероидов, содержащая цитохром Р450 система митохондрий коры надпочечников;
2) система микросомного окисления, включающая множество цитохромов Р450, а также цитохром bs \ 3) дыхательная цепь митохондрий;
4) фотосинтетическая система тилакоидов зеленых растений. Все четыре системы являются основными белковыми компонентами мембран, в которых они локализованы, и могут служить иллюстрацией различных уровней организации мультиферментных комплексов в мембранной энзимологии. Первые две системы катализируют анаболические и катаболические реакции, протекающие в присутствии молекулярного кислорода и обычно липофильных мембраносвязанных субстратов. Терминальные ферменты этих электронтранспортных цепей, цитохром Р450 и десатураза жирных кислот, характеризуются очень низким числом оборотов. Системы и являются основными электронтранспортными ансамблями энергетического обмена, первичная функция которых состоит в переносе протонов через мембрану. Генерируемый при этом градиент электрохимического потенциала протонов используется для синтеза АТР. В отличие от микросомной и митохондриальной систем цитохрома Р450, дыхательная и фотосинтетическая цепи катализируют трансмембранные реакции и характеризуются довольно высоким числом оборотов, 200-300 с " 1. В приведенном ниже кратком обзоре основное внимание обращается на частные вопросы, интересные с точки зрения энзимологии, отмечаются некоторые общие черты, а также представляющие особый интерес дискуссионные моменты.
