Основы химии
Метод МО хорошо объясняет и молекулы и молекулярные частицы, состоящие из разных элементов.
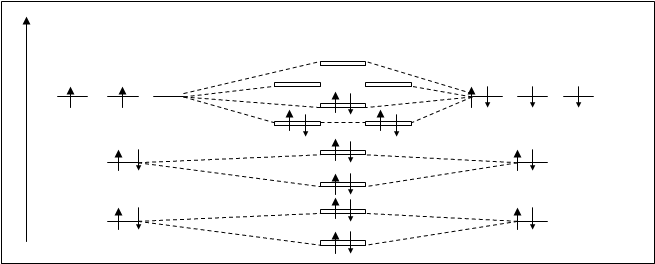
Молекула СО.
Оба атома – углерод и кислород – имеют на внешнем уровне одинаковое количество орбиталей, но у углерода на два электрона меньше (углерод:2s22p2; кислород: 2s22p4).
 А.О. МО А.О.
А.О. МО А.О.
C CO O
spxраз
ppyраз ppzраз
2P spxсв 2P
ppyсв ppzсв
s2sраз
2S s2sсв 2S s1sраз
1S s1sсв 1S Рис.4.26. Схема расположения молекулярных орбиталей СО.
При взаимодействии атомных орбиталей углерода с атомными орбиталями кислорода получаются молекулярные орбитали СО, аналогичные как по форме, так и по взаимному расположению, орбиталям гомоядерных молекул, например N2. Энергетическая схема молекулы СО показана на рисунке 4.26.
В молекуле СО четырнадцать электронов. Они распределены по МО в соответствии известных трех принципов. На связующих орбиталях находится 10 электронов, а на разрыхляющих – только четыре. Кратность связи равна 3, как у молекулы N2. Следовательно ,молекула СО должна быть очень устойчивой и, в действительности, СО напоминает молекулу N2, энергия диссоциации СО равна 1069 кДж/моль, что на 129 кДж/моль больше, чем энергия диссоциации N2. Можно сказать, что молекула СО изоэлектронная молекуле N2. Электронная формула молекулы следующая: С+О=СО[(s1sсв)2 (s1sраз)2 (s2sсв)2 (s2sраз)2 (ppy,zсв)4 (spxсв)2].
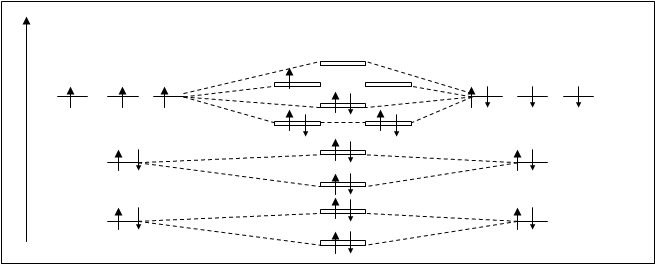
Молекула NO. Энергетическая диаграмма этой молекулы схожа с диаграммой частицы O+2 (табл.4.2.). Схема представлена на рис 4.27.
 А.О. МО А.О.
А.О. МО А.О.
N NO O
spxраз
ppyраз ppzраз
2P spxсв 2P
ppyсв ppzсв
s2sраз
2S s2sсв 2S s1sраз
1S s1sсв 1S Рис.4.27. Схема расположения молекулярных орбиталей NО.
Молекула NO имеет неспаренный электрон, она парамагнитна. Кратность связи 2,5. Электронная формула NO:
[(s1sсв)2 (s1sраз)2 (s2sсв)2 (s2sраз)2 (ppy,zсв)4 (spxсв)2 (ppy,zраз)1].
Некоторые характеристики гетероядерных молекул и частиц, полученных из элементов второго периода даны в табл.4.3.
Таблица 4.3.
|
Молекула, частица. |
Электронная конфигурация. |
Кратность связи. |
Длина связи, А. |
Энергия диссоциации кДж/моль |
|
BN |
[C2] |
2 |
1,28 |
385 |
|
CN+ |
то же |
2 |
1,17 | |
|
BO |
[N2+] |
2,5 |
1,20 |
800 |
|
CN |
то же |
2,5 |
1,17 |
756 |
|
CO+ |
то же |
2,5 |
1,12 | |
|
NO |
[O2+] |
2,5 |
1,15 |
627 |
|
CN- |
[N2] |
3 |
1,14 |
940 |
|
CO |
то же |
3 |
1,28 |
1069 |
|
NO+ |
то же |
3 |
1,062 |
1048 |
Многоатомные молекулы. В качестве примера рассмотрим молекулы СН4, NH3, CO2.
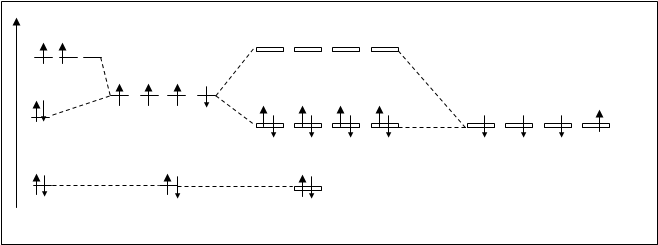
Молекула СН4. Выше было показано (4.3.1.), что атомные орбитали углерода в процессе взаимодействия с другими элементами (в частности с водородом) претерпевают перестройку, названную гибридизацией и в молекуле СН4 все связи идентичные и неразличимые. Эта особенность должна быть отражена и в методе молекулярных орбиталей. На схеме, приведенной на рисунке 4.28.,наряду с АО углерода показаны гибридные орбитали.
 Е А.О. А.О. МО А.О.
Е А.О. А.О. МО А.О.
С исходн. С гибр. СН4 4sхраз 4Н
2Р
4sхсв(или sсвs,x,y,z)
2SP3
1S
1S ss*
Рис.4.28. Схема расположения молекулярных орбиталей СН4.
1S-атомная орбиталь углерода, содержащая два электрона как орбиталь, лежащая в глубине атома, участие в образовании связи не принимает. Она без изменения переходит в молекулярную несвязывающую орбиталь. На рис.4.28. она обозначена ss*. В образовании МО принимает участие 8 атомных орбиталей (четыре от атома углерода и четыре от четырех атомов водорода). Следовательно, образуется 8 молекулярных орбиталей: 4 – связывающих и 4 – разрыхляющих. Заполняются электронами только все связывающие орбитали. Так как направление всех связей между атомом углерода и каждым из водородов совпадают с линией, связывающей центры атомов, и по прочности одинаковы, то все связывающие молекулярные орбитали находятся на одном и том же энергетическом уровне и обозначены одинаково sхсв. Аналогично и разрыхляющие. Электронная формула молекулы может быть записана так: СН4 [4*(sхсв)2].
Молекула NH3.
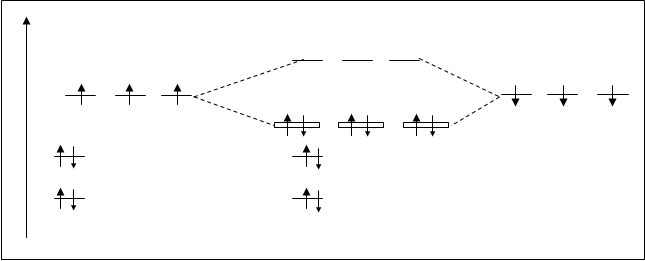 В отличие от СН4 в молекуле NH3 имеется еще одна несвязывающая орбиталь s2s*, т.к. 2s-атомная орбиталь азота практически не принимает участия в образовании связей. Схема расположения МО NH3 представлена на рис. 4.29.
В отличие от СН4 в молекуле NH3 имеется еще одна несвязывающая орбиталь s2s*, т.к. 2s-атомная орбиталь азота практически не принимает участия в образовании связей. Схема расположения МО NH3 представлена на рис. 4.29.
Е АО МО АО
N NH3 3H
sх,y,zраз
2P sх,y,zсв(или 3sхсв) 2P
2S s2s*
1S s1s*
Рис.4.29. Схема расположения МО в молекуле NH3 .
Электронная конфигурация молекулы NH3 :N+3H= NH3 [(ssсв)2(sy)2 (sz)2] или [3(sx)2].
Кратность связи в таких многоатомных молекулах определяется по известному принципу, но затем необходимо разделить на число связей. К.С. N-H=(6-0/2):3=1
Молекула СО2.
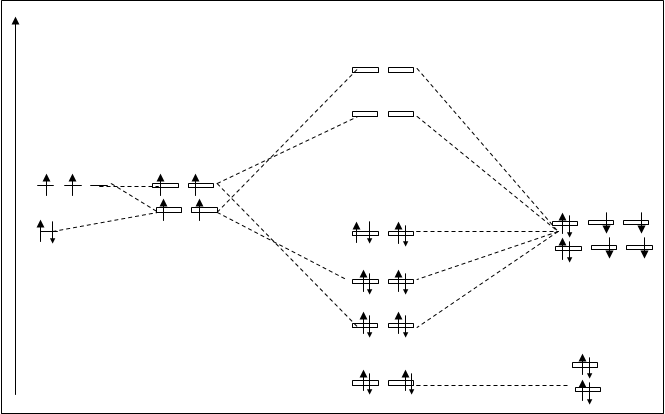 При взаимодействии углерода с кислородом атомные орбитали углерода претерпевают гибридизацию. На рисунке 4.30. показана схема расположения МО в молекуле СО2. На этой схеме не указаны 1s атомные орбитали углерода и обеих кислородов, т.к. они являются внутренними, во взаимодействие не вступают, остаются несвязывающими орбиталями.
При взаимодействии углерода с кислородом атомные орбитали углерода претерпевают гибридизацию. На рисунке 4.30. показана схема расположения МО в молекуле СО2. На этой схеме не указаны 1s атомные орбитали углерода и обеих кислородов, т.к. они являются внутренними, во взаимодействие не вступают, остаются несвязывающими орбиталями.
