Основы химии
Такая структура обеспечивает мягкость графита и его удивительную слойность, что позволяет применять графит для карандашей и в качестве смазочного материала (графитовой смазки).
Цепочные структуры. Как известно, молекулярные решетки имеют место в органической химии. В молекулярных решетках связь между молекулами осуществляется ван–дер–вальсовыми силами.
Значительный интерес представляют волокнистые строения ряда растительных и животных продуктов (целлюлоза, шелк, мускулы, нервные ткани и др.), сообщающие изделиям из таких продуктов своеобразные механические свойства (ткани, нити, веревки, бумага и т.д.).
Эти волокна образованы нитями, связаны ван–дер–вальсовыми силами, а сами нити состоят из длинной цепочки, образованной правильным чередованием атомных групп, связанных между собой ковалентными силами. Такие цепочки можно рассматривать как гигантские линейные молекулы.
Глава 8.
Энергетика химических процессов.
Любой химический процесс сопровождается тем или иным энергетическим эффектом: выделение или поглощение теплоты, света, выполнением электрической или механической работы.
Знание энергетических эффектов химических реакций необходимы не только химикам.
Раздел химии, в котором изучаются энергетические эффекты химических реакций, их зависимость от химического состава, строения и состояния веществ от условий проведения процессов, называется термохимией. Термохимия является составной частью химической термодинамики – области физической химии, в которой на основе законов общей термодинамики изучаются тепловые балансы химических реакций в различных условиях, устанавливается возможность и направление химических процессов. С помощью химической термодинамики выводятся законы химического и фазового равновесия и смещение этих равновесий в зависимости от изменения параметров состояния: температуры, давления, концентрации и др.
Для более глубокого понимания химической термодинамики необходимы рассмотреть ряд основных понятий этой науки.
8.1. Основные понятия и определения.
· Термодинамическая система. Объект исследования в термодинамике называется системой. Термодинамической системой может быть любой макро***ческий объект (тело или группа тел, находящихся во взаимодействии, клоба с раствором вещества, штатив с набором химических реактивов и т.п.) выделенный из окружающей среды с помощью реально существующей или воображаемой поверхности раздела.
 |
Термодинамическая система – комплекс взаимодействующих между собой физических тел реально или мысленно обособленный от окружающей среды
поверхность раздела
![]() окружающая термодинамическая окружающая
окружающая термодинамическая окружающая
среда система среда
поверхность раздела
Для системы физическая граница не обязательна. Систему можно мысленно обосабливать от окружающей среды. Система может состоять из однородных частей, одинаковым по физическим и химическим свойствам и не однородных.
·  Фаза.
Фаза.
Совокупность всех однородных частей системы, одинаковых по физическим и химическим свойствам и ограниченных от других частей системы поверхностью раздела называют Фазой
Различают системы однофазовые (гомогенные) и многофазовые (гетерогенные).
· Гомогенная система – система состоящая из одной фазы. Это однородная система. Интенсивные свойства такой системы одинаковы во всех ее частях.
Гомогенной может быть система, состоящая из газообразных веществ. Жидкофазная система тоже может быть гомогенной.
· Гетерогенная система – система состоящая из двух или более фаз. Между фазами имеется поверхность (граница) раздела. Это не однородная система. Хотя бы одно интенсивное свойство (например вязкость) изменяется скачком.
Примерами гетерогенной системы могут быть две несмешиваемые жидкости, находящиеся в колбе или кусочек металла, опущенный в раствор соляной кислоты.
Термодинамическая система, соприкасаясь с окружающей средой, может через поверхность раздела обмениваться с ней энергией и веществом или не обмениваться. В этом отношении различают изолированные системы и неизолированные.
· Изолированные системы – это системы, у которых через поверхность раздела не может происходить обмен с внешней средой ни энергией, ни веществом.
Т.е. изолированной называют систему, имеющую, в частности, постоянный объем и лишенную возможности обмениваться с окружающей средой как веществом, так и энергией. Например: колба с водой, закрытая пробкой и температура воды такая, как окружающей среды. (Система будет изолированной).
· Неизолированные системы могут быть закрытыми и открытыми.
¾ закрытые неизолированные – такие системы, в которых через поверхность раздела может проходить обмен с внешней средой только энергией. Веществом система не обменивается.
¾ открытые неизолированные – такие системы, в которых через поверхность раздела происходит обмен с внешней средой и веществом и энергией.
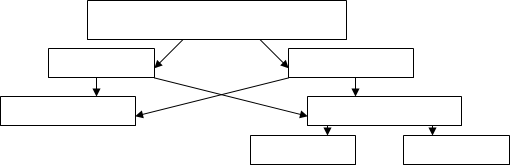 |
Термодинамическая система
гомогенная гетерогенная
изолированная неизолированная
закрытая открытая
Состояние системы определяет совокупность ее химических и физических свойств и описывается с помощью ряда переменных величин – параметров состояния (Р –давление, m –масса, Т –температура, С –концентрация, Е –энергия и т.д.). С помощью параметров состояния можно вывести другие переменные величины, которые называют термодинамическими функциями. (U –внутренняя энергия, Н –энтальпия, S –энтропия, G –энергия Гиббса, F –энергия Гельмгольца).
Это значит, что любая термодинамическая система, характеризуется с одной стороны параметрами состояния, а с другой – термодинамическими функциями.
![]()
![]() характеризуется характеризуется
характеризуется характеризуется
![]()
![]() Параметрами Термодинамическая Термодинамическими
Параметрами Термодинамическая Термодинамическими
состояния система функциями
Р –давление U –внутренняя энергия
Т –температура Н –энтальпия
V –объем S –энтропия
m –масса G –энергия Гиббса
С –концентрация F –энергия Гельмгольца
Е –энергия
· Параметры состояния – термодинамические параметры – независимые термодинамические переменные: P, T, V и т.д.
· Термодинамические функции – функции состояния – величины, зависящие от термодинамических параметров состояния и не зависящие от пути перехода системы из одного состояния в другое (U, H, S, G, F).
